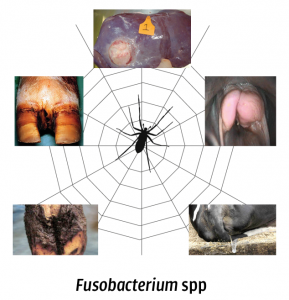
Necrobacillose bij het rund, een term die meer betekent dan je denkt
Necrobacillose is een verzamelnaam voor infecties die gepaard gaan met necrose. Deze aandoening kan bij dieren overal in het lichaam plaatsvinden. De veroorzaker hiervan draagt de naam Fusobacterium necrophorum. De meest voorkomende aandoening die deze bacterie bij koeien veroorzaakt zijn leverabcessen. Klauwproblemen in koeien en schapen, oropharyngeale abcessen (difterie) bij kalveren en endometritis in koeien komen ook veelvuldig voor en worden meestal veroorzaakt door gemengde infecties van F. necrophorum en andere pathogene bacteriën (1, 2, 3, 4).
Fusobacterium necrophorum
Fusobacterium necrophorum is een gram negatieve, niet beweeglijke en niet sporevormende anaërobe kiem die zeer pleomorf is. De kiem is facultatief pathogeen en behoort tot de normale flora van het spijsverteringstelsel en ademhalingsstelsel bij koeien. Een typische eigenschap is dat deze bacterie de mogelijkheid heeft om propionzuur uit melkzuur te produceren.
Van Fusobacterium necrophorum zijn er 4 subspecies geïdentificeerd. De twee belangrijkste subspecies zijn F. necrophorum subspecies necrophorum (biotype A) en F. necrophorum subspecies funduliforme (biotype B). Deze twee zijn morfologisch, biologisch en biochemisch verschillend van elkaar. Het subspecies necrophorum is meer virulent en wordt frequenter geïsoleerd uit infecties dan subspecies funduliforme welke dan weer dikwijls gevonden wordt bij gemengde infecties.
Virulentiefactoren
De virulentiefactoren betrokken bij de pathogenese van Fusobacterium necrophorum zijn leukotoxine, endotoxisch lipopolysaccharide (LPS), hemolysine, hemaglutinine, adhesines of pili en verschillende extracellulaire enzymen met inbegrip van proteasen en deoxyribonucleasen. Al deze virulentiefactoren dragen bij tot de intrede, kolonisatie, proliferatie van het organisme én de ontwikkeling van laesies.
In onderstaande tabel vindt u een overzicht van de verschillende virulentiefactoren van Fusobacterium necrophorum.
| Factoren | Karakteristieken | Werkingsmechanismen | Rol in de infectie |
| Leukotoxine | Extracellulair eiwit | Cytotoxisch voor neutrofielen, macrofagen, hepatocyten en epitheliale cellen van herkauwers |
|
| Endotoxine | Celwand component, lipopolysaccharide (LPS) | Heeft een necrotisch effect en veroorzaakt diffusie intravasale stolling (DIS) |
|
| Hemolysine | Extracellulair, maar cel geassocieerd eiwit | Veroorzaakt lyse van erythrocyten |
|
| Hemagglutinine | Waarschijnlijk een eiwit celwand geassocieerd eiwit | Agglutineert erythrocyten |
|
| Adhesine | Extracellulair, waarschijnlijk een eiwit | Hecht zich vast aan de celwand van eukaryoten |
|
| Dermonecrotisch toxine | Celwand geassocieerd eiwit | Veroorzaakt necrose in het epitheel |
|
| Trombocyten aggregatie factor | Celwand geassocieerd eiwit | Breekt celeiwit af |
|
| Protease | Extracellulair proteïne | Breekt celeiwit af |
|
Het potente leukotoxine met hoog moleculair gewicht wordt gezien als één van de belangrijkste virulentiefactoren betrokken bij Fusobacterium infecties in dieren. Het is cytotoxisch voor neutrofielen, macrofagen, hepatocyten en waarschijnlijk ook voor de pens epitheelcellen van herkauwers. Het toxine induceert bij een lage concentratie apoptose, bij een hogere concentratie veroorzaakt het lyse van de cellen. Deze cytotoxiciteit is actiever tegen polymorfonucleaire cellen dan tegen lymfocyten.
Dat leukotoxine heel toxisch is voor de polymorfonucleaire leukocyten van herkauwers blijkt uit een cytotoxiciteit studie uitgevoerd binnen verschillende diersoorten. In deze studie werd aangetoond dat het F. necrophorum leukotoxine hoog toxisch is voor leukocyten van rund en schaap, matig toxisch voor deze van paarden en laag toxisch voor leucocyten van varkens en konijnen.
De mogelijkheid van dit leukotoxine om het immuunsysteem van koeien te beïnvloeden vertegenwoordigt een potentieel belangrijk mechanisme in de pathogenese van de kiem.
Het leukotoxine van F. necrophorum is aanzienlijk omvangrijker (336,000 Da) dan leukotoxines geproduceerd door andere bacteriën zoals Mannheimia hemolytica (104,000 Da) en Staphylococcus aureus (38,000 en 32,000 Da).
Fusobacterium necrophorum infecties in koeien
De betekenis van Fusobacterium necrophorum infecties in koeien wordt hieronder nader toegelicht.
Bacillaire levernecrose en leverabcessen
In het slachthuis worden in de levers vaak ronde, gele vast aanvoelende haarden /abcessen gevonden. Het gaat hier om een necrotiserende hepatitis veroorzaakt door de primaire veroorzaker Fusobacterium necrophorum. Maar ook nog andere anaërobe, facultatieve pathogenen als Bacteroides spp, Clostridium spp, Peptostreptococcus spp en Trueperella pyogenes werden al geïsoleerd uit leverabcessen.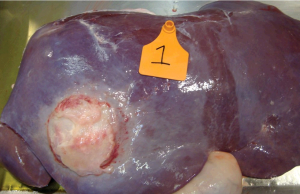
Pathogenese
Leverabcessen zijn vaak secundair aan ruminitis en pensacidose bij dieren die gevoederd worden met veel krachtvoer. Het juiste mechanisme hierachter is nog niet geheel opgehelderd, maar men gaat er vanuit dat de snelle fermentatie van het krachtvoer zorgt voor een verhoogde synthese van vluchtige vetzuren en lactaat. Dit resulteert in pensacidose. De geïnduceerde ruminitis, samen met eventueel schade aan het epitheel door vreemde voorwerpen (zie tabel), kan helpen bij de invasie van Fusobacterium necrophorum. Langs deze weg kan de bacterie een abces veroorzaken in de penswand of verder koloniseren naar het bloed om zo in de portale circulatie terecht te komen, om dan gecapteerd te worden in de lever met een infectie als gevolg. Dit proces gaat niet zonder slag of stoot. Immers de zuurstofrijke omgeving in de lever en het hoog immunogeen karakter van dit orgaan, beschermd door massa’s fagocyten, zijn voor de facultatieve anaeroben geen ideaal milieu. De verschillende virulentiefactoren vermeld in de tabel spelen elk een rol in de pathogenese. Zo beschermen het leukotoxine en het endotoxisch LPS de kiem tegen fagocytose. De cytolytische stoffen vrijgekomen ten gevolge van de vernietiging van de fagocyten zorgen voor een negatieve invloed op het parenchym van de lever. Daarbij zorgen de intravasculaire coagulatie door LPS en trombocyten aggregatie factor, de vorming van fibrinekapsels en het gebrekkig zuurstoftransport ervoor dat de bacterie kan overleven in de penswand en de lever.
Bacteriën geïsoleerd uit leverabcessen uit gedode koeien uit het slachthuis overgenomen uit Purvis 2006.
| Leverabcessen bij koeien | ||
| Bacteriën | Acidosis en ruminitis (n=28) | Reticuloperitonitis (n= 29) |
| Fusobacterium necrophorum | 20 | 29 |
| Subspecies necrophorum | 13 | 26 |
| Subspecies funduliforme | 8 | 9 |
| Trueperella pyogenes | 15 | 11 |
| Clostridium perfringens | 5 | 2 |
In een recente studie werd ook Salmonella enterica geïsoleerd uit de leverabcessen. Een verklaarbare theorie hiervoor zou zijn dat de Salmonella aanwezig in de darm, de darmbarrière zou passeren ter hoogte van de dunne of dikke darm en zo via de lymfeknopen tot in de portale circulatie komt om daar gefiltreerd te worden door het portaal capillair systeem om dan zo infectie te veroorzaken. Verdere studies zullen het belang van deze kiem in het veroorzaken van leverabcessen nog moeten aantonen.
Als complicatie van de leveraantasting kan de vena cava aangetast worden, met flebitis en thromboflebitis als gevolg. Geïnfecteerde thrombi kunnen loslaten en zo pneumonie en longbloedingen veroorzaken.
Incidentie
Alhoewel het voorkomen van leverabcessen in de eerste plaats een probleem geeft in de vleesindustrie kampen ook melkkoeien soms met het probleem. Leverabcessen komen vrij vaak voor; de laatste jaren werd er wereldwijd een incidentie van 10 tot 20 % gezien.
De incidentie is natuurlijk gerelateerd aan bepaalde factoren zoals het dieet, ras, geslacht, geografische locatie en het seizoen.
Symptomen
De symptomen zijn niet zeer specifiek: algemeen ziek, koorts, diarree of obstipatie en natuurlijk leverfunctiestoornissen.
Diagnose
Een goede diagnose kan alleen postmortaal of door het nemen van een leverbiopt gesteld worden.
Therapie
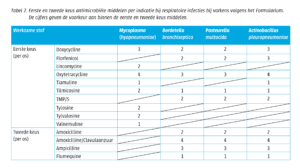
In eerste plaats dient het voedermanagement aangepast te worden om pensontsteking en acidose te voorkomen. Langdurige antibioticumtherapie met procaïne benzylpenicilline geeft een matig resultaat. In Amerika wordt er in de feedlots veelvuldig gevaccineerd hiertegen met een sterke daling van het aantal leverabcessen als gevolg.
Klauwaandoeningen: Panaritium
Panaritium, ook tussenklauwontsteking, interdigitale necrobacillose, kleipoot, slakkepoot of tussenklauwflegmoon genoemd, is een ontsteking van het weefsel van de tussenklauwspleet. 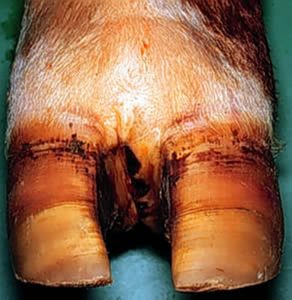
Pathogenese
Tussenklauwontsteking ontstaat altijd door een beschadiging, een wondje door bijvoorbeeld steentjes, zaagselsplinters of slechte loopvlakken. De ontsteking zelf ontstaat door de aanwezigheid van necrose veroorzakende bacteriën: door deze bacteriën sterft het weefsel af. Fusobacterium necrophorum is de meest geïsoleerde kiem bij panaritium, maar ook andere strikt anaërobe bacteriën zoals voornamelijk Trueperella pyogenes, Bacteroides melaninogenicus, Peptostreptococcus spp en minder frequent Bacteroides fragilis worden aangetroffen.
Necrophorum en T. pyogenes zijn synergistische kiemen die producten vormen die elkaars groei gunstig kunnen beïnvloeden. Deze twee bacteriën vormen ook exotoxines die necrose veroorzaken en zo de vaatwanden ter hoogte van de ondervoet kunnen beschadigen. Hierdoor treedt vocht naar buiten met zwelling tot gevolg. Het gevaar bestaat dat de infectie zich uitbreidt naar peesscheden, pezen, gewrichtskapsels, gewrichtsbanden en gewrichten ter hoogte van de ondervoet. Uitzaaiingen via de bloedbaan naar andere weefsels en organen kunnen voorkomen.
Symptomen
Dieren met interdigitale necrobacillose vertonen acute claudicatie en hoge koorts. Zonder behandeling kunnen de diepere weefsels van de ondervoet worden aangetast. Evacuatie van necrotisch materiaal gebeurt door fistelvorming aan de kroonrand of in de tussenklauwspleet.
Behandeling
Bij panaritium is het van groot belang om de koe snel te behandelen om de vorming van een tyloom en het nog verder naar binnen slaan van de ontsteking te voorkomen. Indien men heeft vastgesteld dat het om tussenklauwontsteking gaat, is het parenteraal behandelen met antibiotica (procaïnebenzylpenicilline, oxytetracycline of tylosine) noodzakelijk. Dopharma heeft in haar assortiment Oxymax® 100 mg/ml, een product dat onder andere is geregistreerd voor de behandeling van panaritium door Fusobacterium necrophorum. Ook is het bevorderlijk om de harde hoornranden in de tussenklauwspleet te verwijderen en oxytetracyclinespray op de wond in de tussenklauwspleet te spuiten.
Een gunstig stalklimaat, schone, degelijke loopvlakken (geen kans op beschadigingen van buitenaf) en regelmatig gebruik van voetbaden helpt tussenklauwontsteking te voorkomen..
Klauwaandoeningen: Stinkpoot
Stinkpoot begint als een infectie van de tussenklauwhuid en geeft in een later stadium groeven en kloven in het hoorn van het balgebied. De naam stinkpoot komt van de stank die deze aandoening veroorzaakt. De klauwaandoening stinkpoot staat ook wel bekend als dermatitis interdigitalis.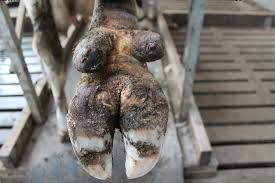
Pathogenese
De oorzaak van deze aandoening is een bacteriële infectie van Dichelobacter nodosus en Fusobacterium necrophorum. Uitgesproken gevallen van stinkpoot worden vooral gezien bij oudere melkkoeien die langdurig binnen gehuisvest zijn. Een slechte hygiëne en een slecht, vochtig stalklimaat geven de bacteriën de kans om de klauwen aan te tasten. Dit is te voorkomen door de stal goed te ventileren en door op de roosters gebruik te maken van een mestschuif. Hierdoor blijven de klauwen droger en harder, waardoor ze minder gevoelig zijn voor infecties.
Symptomen
De symptomen van stinkpoot zijn afhankelijk van de fase waarin de aandoening zich bevindt. Stinkpoot begint als een oppervlakkige ontsteking van de tussenklauwhuid, met name in het balgebied. Het is vochtig en het stinkt. De koe heeft nog nergens last van en loopt ook niet kreupel. In de volgende fase wordt de balhoorn aangetast. In deze fase ontstaan ook kloven en hoornmisvormingen. Als laatste treedt de hoornvorming op de voorgrond. Dit gebeurt met name bij de achterbuitenklauw. Op den duur kunnen complicaties optreden. Tylomen zijn hier een goed voorbeeld. De kloven in het balgebied bieden de veroorzakers van Mortellaro dan weer de kans om aan te slaan.
Behandeling
Stinkpoot wordt in de eerste plaats behandeld door de klauw te bekappen. Overtollig hoorn wordt hierbij weggesneden, daarna worden koeien meestal door een voetbad gestuurd.
De beste preventieve maatregelen zijn een goede hygiëne en regelmatig bekappen.
Orale necrobacillose
Deze aandoening komt voornamelijk voor bij kalveren jonger dan één maand. Het betreft hier aan aantasting van het wangslijmvlies en van de tong.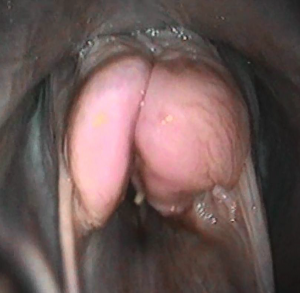
Symptomen
De dieren vertonen verminderde eetlust en speekselvloei, de tongpunt steekt uit de bek en het voedsel blijft stagneren in de wang. Bij inspectie in de bek is het slijmvlies geelgrauw van kleur en stinkt.
Necrotische laryngitis/kalverdifterie
Zoals eerder vermeld is Fusobacterium necrophorum ook een van de meest geïsoleerde anaërobe kiemen uit abcessen in luchtweginfecties. Laryngitis of necrobacillose van de laynx is een acute tot chronische infectie van de laryngeale mucosa en van het arytenoid kraakbeen. Op sommige bedrijven is deze infectie enzoötisch aanwezig (Belgisch witblauw).
Pathogenese
De opname van de kiem gebeurt oraal of via inhalatie. De kiem is niet in staat de intacte mucosa te penetreren. Kleine wonden, de zo genaamde contactulcera, fungeren als intredepoort en zorgen er zo voor zorgen dat de kiem in diepere weefsels kan doordringen en een necrotiserende infectie kan veroorzaken. Deze contactulcera kunnen ontstaan ten gevolge van infecties van de luchtwegen en kan veroorzaakt worden door zowel virussen als bacteriën. Ook het veelvuldig hoesten en het veelvuldig slikken bij een luchtweginfectie zorgen voor beschadigingen, erosies en ulceraties van de gezwollen larynxmucosa.
Op bedrijven met een slechte huisvesting wordt de ziekte het vaakst opgemerkt. Slechte ventilatie, hoge vochtigheidsgraad, overbezetting en onhygiënische omstandigheden zorgen ervoor dat de bacterie meer kans heeft om het dier te infecteren. Daarnaast zijn een gebrek aan vitamine A (hyperkeratose en meerlagig verhoornd epitheel ) en irriterende gassen predisponerende factoren voor het ontstaan van contactulcera.
Symptomen
De symptomen kunnen een acuut karakter vertonen. Echter, soms treden de ziekteverschijnselen progressief of intermitterend op. Vaak begint het met hoest, eventueel met een bilaterale neusuitvloeiing.
Het meest typische symptoom is de inspiratoire stridor door de ontsteking en de necrose ter hoogte van de larynx en de daarmee gepaard gaande zwelling. Wanneer de stridor erg toeneemt, wordt ook de dyspneu erger. Soms met sterfte door verstikking als gevolg.
Wanneer de larynx wordt onderzocht dan vindt men zwelling, necrose en granulatieweefsel op de arytenoiden
Ook verminderde beweeglijkheid van de arytenoiden en een vernauwing van de glottis wordt heel dikwijls opgemerkt.
Bij langdurige bacteriële laryngitis kunnen eveneens chronische tympanie en longabcessen voorkomen.
Diagnose
Meestal wordt de diagnose gesteld aan de hand van de symptomen, maar endoscopisch onderzoek kan duidelijkheid geven.
Bacteriologisch onderzoek kan door de kiemen te enten op bloedagar; stalen moeten zo snel mogelijk geënt worden en gedurende meerdere dagen geïncubeerd worden onder anaërobe omstandigheden.
Behandeling
Medicamenteuze behandeling met een eerste keus antibiotica (procaïnebenzylpenicilline, oxytetracycline of tylosine ) en NSAID’s worden in eerste instantie geadviseerd. Dopharma heeft in haar assortiment Oxymax® 100 mg/ml, een product die onder andere is geregistreerd voor de behandeling van necrobacillose. Wanneer dit niet helpt dan kan een operatie het lijden verhelpen.
Endometritis
Ook bij endometritis speelt Fusobacterium necrophorum een rol, al is het maar een ondergeschikte rol.
Meerdere bacteriën worden als veroorzakers gezien in deze aandoening. In een review over de risicofactoren van klinische en subklinische endometritis in koeien zijn Escherichia coli en Trueperella pyogenes aangetoond als de meest frequent geïsoleerde bacteriën uit het uteruslumen bij koeien met uterusinfecties, gevolgd door anaërobe bacteriën zoals Provetella spp, Fusobacterium necrophorum en Fusobacterium nucleatum. Hieronder een overzicht van de belangrijkste veroorzakers van uteriene problemen.
| Pathogenen | Potentiële pathogenen | Opportunistische pathogenen |
| Trueperella pyogenes | Bacillus licheniformis | Clostridium perfringens |
| Bacteroides spp | Enterococcus faecalis | Klebsiella pneumoniae |
| Prevotella melaninogenicus | Mannheimia haemolytica | Micrococcus spp |
| Escherichia coli | Pasteurella multocida | Proteus spp |
| Fusobacterium necrophorum | Peptostreptococcus spp | Staphylococcus spp, coagulase –negative α-hemolytic streptococci |
| Staphylococcus aureus | Streptococcus acidominimus | |
| Steptococci, nonhemolytic | Aspergillus spp |
Endometritis is een multifactorieel probleem met veel intrinsieke en extrinsieke factoren die meespelen in het ontstaan ervan. Door de ondergeschikte rol van Fusobacterium necrophorum in het metritis-endometritisprobleem wordt deze ziekte niet behandeld in dit artikel.
Zoönose
Humaan veroorzaakt Fusobacterium een zere keel en tonsillitis in jonge volwassenen, wat in bepaalde omstandigheden kan leiden tot een complicatie genoemd het syndroom van Lemierre (Kupalli et al, 2012). De Fusobacterium stam die deze ziekte veroorzaakt is verschillend van deze bij koeien en lijkt meer op de subspecies funduliforme.
Dopharma producten
Dopharma heeft ook enkele producten in het assortiment die ingezet kunnen worden bij de behandeling van luchtweginfecties, klauwproblemen en metritis.
| Fusobacterium necrophorum
veroorzaker van: |
Luchtweginfecties | Difterie | Klauwproblemen | Metritis |
| Dofatrim-ject® |
x |
x |
||
| Oxyject 10% |
x |
x |
||
| Oxy LA INJ |
x |
|
||
| Oxymax® 100 mg/ml |
x |
x |
||
| Penstrep-ject® |
x |
|
x |
|
| Sulfadimidine-Na |
x |
|||
| Tildosin® 300 mg/ml |
x |
|||
| TMP/SMZ INJ. |
x |
Referenties
- Fusobacterium necrophorum Leukotoxin Induces Activation and Apoptosis of Bovine Leukocytes† – S. Narayanan, 2002.
- Fusobacterium necrophorum: its characteristics and role as an animal pathogen – Langeworth, B.F., 1977.
- Necrobacillosis associated with Fusobacterium necrophorum – Nagaraja T.G., 1998
- Liver abscesses in feedlot cattle – Nagaraja, T. G., et al, 1998.
- Fusobacterium necrophorum infections: virulence factors, pathogenic mechanism, and control measures – Tan, Z. L. et al, 1996.
- Fusobacterium necrophorum infections in animals: Pathogenesis and pathogenic mechanisms – T.G. Nagaraja et al, 2005.
- Bacterial complications of postpartum uterine involution in cattle – Földi et al, 2006.
- Effect of postpartum manual examination of the vagina on uterine bacterial contamination in cows – Sheldon et al, 2002.
- Defining postpartum uterine disease in cattle – Sheldon et al, 2006.
- Mechanisms of infertility associated with clinical and subclinical endometritis in high producing dairy cattle – Sheldon et al, 2009.
- Risk factors of clinical and subclinical endometritis in cattle – Adnane et al, 2017.
- Leukotoxins of Gram-negative bacteria – Narayannan SK et al, 2002.
- Liver abscesses in cattle: A review of incidence in Holsteins and bacteriology and vaccine approaches to control in feedlot cattle – R.G. Amachawadi et al, 2016.
- Fusobacterium necrophorum :A ruminal bacteria that invades liver to cause abscesses in cattle – Tadepalli et al, 2008.
Bronvermeldingen
- Leverabces
- Panaritium
- Stinkpoot
- Difterie: Lien Van Damme, UGent (2015-2016)Overlevingsstatistieken van runderen na chirurgische behandeling van laryngeale necrobacillose.
- Endometritis