De laatste jaren is er erg veel aandacht geweest voor de inzet van antimicrobiële middelen in de diergeneeskunde. Het verantwoord inzetten van antibiotica is essentieel voor een optimale werking van het middel, het beperken van resistentie en het waarborgen van de voedselveiligheid. In 2014 heeft Dopharma in haar nieuwsbrief enkele keren een artikel gepubliceerd met praktische informatie over antibiotica. Deze artikelen zijn samengevoegd in één document, wat voor u ook als download (pdf, Engelstalig) beschikbaar is, maar u kunt de tekst ook hieronder lezen.
Verantwoorde inzet van antibiotica betekent niet alleen een reductie van het antibioticumgebruik, maar ook de keuze van het juiste middel in een bepaalde situatie. Belangrijke hulpmiddelen die voor deze keuze gebruikt kunnen worden zijn het antibiogram en de formularia voor de verschillende diersoorten. Binnen een bepaalde keuze in het formularium (1e, 2e, 3e keus) kan, afhankelijk van de gevoeligheid, vaak nog gekozen worden tussen verschillende werkzame stoffen. Kennis van de farmacodynamiek en farmacokinetiek is noodzakelijk om tot een onderbouwde keuze te komen. Ook wanneer in het kader van Good Veterinary Practice (GVP) een geneesmiddel off-label ingezet moet worden is deze kennis essentieel voor de onderbouwing.
Inleiding
Farmacodynamiek & Farmacokinetiek
De farmacodynamiek beschrijft hoe een diergeneesmiddel een effect bereikt in het lichaam. In de overzichtstabel zijn de antibiotica ingedeeld op basis van werkingsmechanisme. In de kolommen worden de belangrijkste eigenschappen besproken. Naast deze eigenschappen is ook het spectrum belangrijk, maar dit wordt hier buiten beschouwing gelaten. In de farmacokinetiek wordt beschreven hoe het lichaam met een diergeneesmiddel omgaat. In de kinetiek kennen we vier belangrijke onderdelen; Absorptie, Distributie, Metabolisatie en Eliminatie (AMDE).
De belangrijkste parameters zijn: Cmax (maximale concentratie), Tmax (tijdstip waarop maximale concentratie wordt bereikt), CL (klaring), T1/2EL (eliminatie halfwaardetijd) en Vd (verdelingsvolume). Deze parameters zijn afhankelijk van de eigenschappen van het diergeneesmiddel, maar ook van de formulering, de toedieningsroute en het doseringsvoorschrift.
Bactericide of Bacteriostatisch
Het verschil tussen bactericide en bacteriostatische antibiotica is algemeen bekend; bactericide antibiotica doden de bacteriën, bacteriostatische antibiotica remmen de groei. In vitro is het onderscheid lastig aan te tonen; niet alle bactericide antibiotica doden alle bacteriën binnen de vastgestelde tijd, terwijl sommige bacteriostatische antibiotica in voldoende hoge doseringen ook in staat blijken een deel van de bacteriën te doden. Praktisch wordt vaak aangenomen dat bactericide antibiotica nodig zijn bij acute infecties of wanneer het immuunsysteem niet optimaal functioneert. In sommige situaties kunnen bacteriostatische antibiotica echter de voorkeur hebben. Snelle sterfte door bactericide antibiotica kan bij endotoxinen bevattende bacteriën bijvoorbeeld de symptomen van een ziekte heftiger maken.
Lipofiliteit & Dissociatieconstante
Om effectief te zijn moet het antibioticum natuurlijk de bacteriën in verschillende weefsels bereiken en is het vaak noodzakelijk dat het geneesmiddel celmembranen kan passeren. Naast actief transport en diffusie door de poriën is vooral de passieve diffusie van geneesmiddelen van belang voor de passage door membranen. Voor deze passieve diffusie zijn vooral de lipofiliteit en de dissociatieconstante van het geneesmiddel van belang. In de tabel wordt per antibioticumgroep de lipofiliteit weergegeven. Een hoog lipofiele stof kan de fosfolipidenstructuur van celmembranen gemakkelijker passeren dan een laag lipofiele stof. Hierdoor bereiken hoog lipofiele stoffen vaak effectieve concentraties in de synovia, het oog en de cerebrospinale vloeistof. Diffusie van matig lipofiele stoffen naar deze weefsels is afhankelijk van de plasma-eiwitbinding, en dus van het verdelingsvolume. Ook dit wordt weergegeven in de tabel.
De dissociatieconstante (pKa) van een geneesmiddel geeft aan in welke mate het zich in geïoniseerde en in niet-geïoniseerde toestand bevindt. Het passeren van een celmembraan door passieve diffusie is alleen mogelijk als de stof zich in niet-geïoniseerde toestand bevindt. Bij een pH verschil tussen twee weefsels (bijvoorbeeld bloed en longweefsel) zal een antibioticum zich, afhankelijk van de pKa in één van deze weefsels ophopen. Zwakke basen zullen ophopen in het weefsel met de lagere pH en zwakke zuren zullen zich ophopen in het weefsel met de hogere pH. Dit fenomeen wordt ion trapping genoemd. In het lichaam gaat het vooral over het pH verschil tussen plasma en de weefsels en het verschil tussen de intracellulaire en extracellulaire pH. Voorbeelden van weefsels met een pH die lager is dan de pH van het plasma zijn de longen, de prostaat, melk en de urine van carnivoren. De urine van herbivoren heeft een pH die hoger is dan de pH van het plasma. Ter illustratie: Om hoge weefselconcentraties in de longen te krijgen, kan het beste gekozen worden voor een lipofiel antibioticum met een hoge pKa.
Concentratie- of Tijdsafhankelijk effect
Bij concentratie-afhankelijke antibiotica zorgt een verhoging van de concentratie voor een snellere en betere remming of doding van bacteriën.
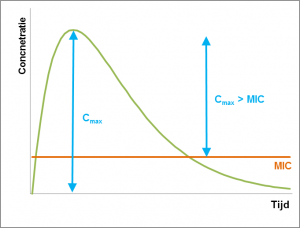
De belangrijkste parameter voor deze antibiotica is de Cmax > MIC. Dit is het verschil tussen de maximale plasma concentratie (Cmax) en de Minimal Inhibitory Concentration (MIC). Voor het bereiken van de beste resultaten moet de Cmax tien keer zo hoog zijn als de MIC. Een zo hoog mogelijke concentratie kan onder andere bereikt worden door antibiotica niet de hele dag beschikbaar te stellen, maar bijvoorbeeld door middel van pulsdosering. De duur dat de concentratie van het antibioticum hoog blijft is in dit geval minder belangrijk, omdat deze antibiotica doorgaans een lang post-antibiotisch (PAE) effect hebben.
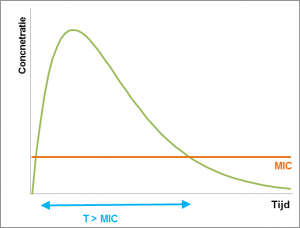
Voor de tweede groep antibiotica is de werking afhankelijk van de periode waarin de bacterie blootgesteld wordt aan het antibioticum. De belangrijkste parameter is de periode waarin de concentratie hoger is dan de MIC (T>MIC). Voor een optimaal effect moet de periode dat de concentratie boven de MIC is, minimaal even lang zijn als de helft van het doseringsinterval. Als bijvoorbeeld uit kinetiekstudies blijkt dat de concentratie van een bepaald antibioticum gedurende een periode van 6 uur boven de MIC blijft, moet een doseringsinterval van maximaal 12 uur gehanteerd worden. Over het algemeen kan aangenomen worden dat deze antibiotica zo vaak mogelijk gedurende de dag aangeboden moeten worden, dus bij voorkeur wordt er continu behandeld.
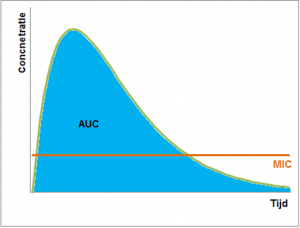
Tot slot zijn er nog enkele antibiotica die beide eigenschappen hebben. Voor deze antibiotica moet dus een hoge concentratie bereikt worden, maar deze moet ook gehanteerd blijven. Hiervoor wordt de AUC (Area Under the Curve) bekeken. De standaard is dat de AUC/MIC groter moet zijn dan 125.
Penicillinen
Farmacodynamiek
Het bactericide werkingsmechanisme van penicillines is gebaseerd op remming van de celwandsynthese. Het peptidoglycaan dat de celwand vormt is opgebouwd uit verscheidene peptideketens en suikers, welke aan elkaar gekoppeld worden door onder andere penicillin-binding-proteins (PBP’s) zoals transpeptidase. Penicillines binden irreversibel aan deze PBP’s, waardoor er geen peptidoglycaan gevormd kan worden. Dit effect is alleen van toepassing op delende bacteriën, omdat alleen dan de celwand geopend wordt en peptidoglycaan nodig is om deze te sluiten.
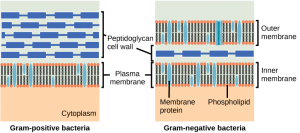
Er is binnen de penicillines een duidelijke scheiding tussen penicillines die effectief zijn tegen gram positieve bacteriën en penicillines die een breed spectrum hebben. Dit wordt deels verklaard door de structuur van de bacteriën. In gram positieve bacteriën bevindt de peptidoglycaan celwand zich aan de buitenkant van de cel, waardoor de PBP’s altijd bereikbaar zijn. In gram negatieve bacteriën wordt de peptidoglycaan celwand nog omgeven door een lipidenlaag, waardoor de PBP’s moeilijker bereikbaar zijn. Dit wordt geïllustreerd in onderstaande figuur. De smal spectrum penicillines zijn niet in staat de lipidenlaag van gram negatieve bacteriën te passeren, terwijl de breed spectrum penicillines dit over het algemeen wel kunnen. Andere factoren die van invloed kunnen zijn op de gevoeligheid voor penicillines zijn de structuur van de PBP’s, de hoeveelheid peptidoglycaan (gram positieve bacteriën hebben veel meer peptidoglycaan) en resistentie door de vorming van verschillende β-lactamase enzymen.
Omdat penicillines de celwandsynthese verstoren, zijn ze niet effectief tegen bacteriën die geen celwand en dus geen PBP’s hebben, zoals Mycoplasma spp. Ook dieren hebben geen PBP’s, wat de grote veiligheidsmarge van penicillines verklaart.
Lipofiliteit & Dissociatieconstante
Penicillines hebben een lage lipofiliteit en een klein verdelingsvolume. De biologische beschikbaarheid van penicillines is over het algemeen dan ook niet erg goed. De uitzondering hierop is penicilline V (phenoxymethylpenicilline). Dit zuurvaste penicilline heeft een betere orale biologische beschikbaarheid dan de andere penicillines. De lage pKa van penicillines is verantwoordelijk voor het kleine verdelingsvolume; in plasma komt het grootste deel van deze antibiotica in geïoniseerde vorm voor en membranen kunnen daarom moeilijk gepasseerd worden. Dit leidt ertoe dat de concentratie in de uier bijvoorbeeld ongeveer slechts één vijfde van de plasmaconcentratie is. De passage over biologische membranen verbetert echter wanneer er sprake is van een ontsteking. Dit komt doordat de pH van ontstoken weefsels daalt, waardoor een groter deel van de penicillines zich in de geïoniseerde vorm zal bevinden. Hierdoor bereiken penicillines tijdens een ontsteking toch werkzame spiegels in weefsels waar ze normaal nauwelijks in doordringen.
Concentratie- of Tijdsafhankelijk effect
Penicillines zijn tijdsafhankelijke antibiotica. Dit betekent dat ze met name effectief zijn als de bacterie gedurende een voldoende lange periode aan het antibioticum wordt blootgesteld. Een continue dosering heeft dan ook de voorkeur boven pulsdosering. Injectiepreparaten worden vaak meerdere keren per dag toegediend of bevatten penicillines gebonden aan procaïne, waardoor het langzaam geabsorbeerd wordt uit de injectieplaats.
Daarnaast bestaat er voor β-lactam antibiotica een fenomeen dat bekend staat als het ‘Eagle Effect’. Een hoge concentratie blijkt bij bepaalde bacteriën (met name Enterococcen spp.) minder effectief te zijn dan de gebruikelijke concentratie. Dit wordt veroorzaakt door een remming van de groei, die belangrijk is voor de werkzaamheid. Dit benadrukt het belang van een juist doseringsschema met langdurige spiegels boven de MIC, maar zonder hoge piekconcentraties.
Combineren van antibiotica
Zoals eerder beschreven, zijn penicillines alleen effectief als ze ingezet worden tegen delende bacteriën. Dit betekent dat deze antibiotica niet gecombineerd kunnen worden met bacteriostatische antibiotica zoals de meeste eiwitsyntheseremmers. Een uitzondering hierop zijn aminoglycosiden; deze antibiotica zijn wel bactericide en de combinatie van β-lactam antibiotica met aminoglycosiden werkt synergistisch, omdat penicillinen zorgen voor een toename van de permeabiliteit van de celwand waar de aminoglycosiden van profiteren.
Resistentie
Resistentie tegen penicillines is doorgaans gebaseerd op β-lactamases. Deze enzymen knippen de β-lactam ring van penicillines open, waardoor ze niet meer kunnen binden aan PBP’s en dus ineffectief zijn. Dit resistentiemechanisme wordt met name overgedragen via plasmiden. Overdracht via plasmiden is vooral effectief in gram negatieve bacteriën, waardoor er bij deze bacteriën een grotere verscheidenheid aan β-lactamases voorkomt dan bij gram positieve bacteriën. Dit betekent dat de mate van resistentie-inductie voor smal spectrum penicillines, die alleen effectief zijn tegen gram positieve bacteriën heel laag is. Breed spectrum penicillines kunnen daarentegen wel redelijk snel resistentie induceren bij gram negatieve bacteriën. Ook uit de GD Monitoring (2012) blijkt dat resistentie tegen deze groep antibiotica met name voorkomt bij gram negatieve bacteriën. S.aureus is een van de weinige gram positieve bacteriën waar antibioticumresistentie tegen penicillines een probleem vormt. Er zijn enkele penicillines die niet gevoelig zijn voor β-lactamases. Een voorbeeld van een niet β-lactamase gevoelige penicilline die veterinair toegepast wordt is cloxacilline. Daarnaast kunnen penicillines gecombineerd worden met β- lactamases inhibitoren zoals clavulaanzuur om deze vorm van resistentie te onderdrukken.
Andere resistentiemechanismen die van belang kunnen zijn voor penicillines zijn aanpassing van de PBP’s en een verlaging van de intracellulaire concentratie van het antibioticum door een efflux pomp of verminderde permeabiliteit. Een verminderde productie van porinen die normaal gesproken gebruikt worden om de buitenste celmembraan te passeren is alleen van belang bij gram negatieve bacteriën zoals E.coli. Dit mechanisme is vaak gekoppeld aan het resistentiemechanisme dat zorgt voor een hogere efflux van β-lactam antibiotica over de buitenste membraan, dat ook alleen zinvol is bij gram negatieve bacteriën.
Specifieke groepen bacteriën die resistentie vertonen tegen penicillinen zijn MRSA, ESBL en AmpC producerende kiemen. Methicilline resistente Staphylococcus aureus (MRSA) is ongevoelig voor vrijwel alle β-lactam antibiotica. Deze resistentie wordt veroorzaakt door een chromosomale mutatie op het mecA gen. Dit gen codeert voor een PBP met een afwijkende structuur, waardoor deze vrijwel ongevoelig wordt voor β-lactam antibiotica. Extended β-lactamase (ESBL) producerende bacteriën zijn ongevoelig voor penicillines, cefalosporines en monobactams, omdat ze deze β-lactam antibiotica afbreken. Deze bacteriën zijn wel gevoelig voor carbapenems en β-lactamase inhibitoren. AmpC producerende bacteriën zijn een subgroep binnen de ESBL producerende bacteriën. Bacteriën die dit enzym produceren zijn in tegenstelling tot de vorige groep ook ongevoelig voor β-lactamase inhibitoren. Carbapenems zijn dan de enige behandelmogelijkheid. Er zijn geen veterinair geregistreerde antibiotica binnen deze groep.
Cefalosporines, Polymyxinen en Fluoroquinolonen
Farmacodynamiek
Cefalosporinen en polymyxinen grijpen aan op de celwand van de bacteriën en hebben beide een bactericide werking. Cefalosporinen zijn, evenals de penicillines, β-lactam antibiotica en zorgen voor een remming van de celwandsynthese door binding aan de penicilline bindende eiwitten (PBP’s). Hierdoor kunnen de peptidoglycaanmoleculen waaruit de celwand is opgebouwd niet aan elkaar gekoppeld worden. In de alinea over penicillinen wordt dit werkingsmechanisme nader toegelicht. De eerste en tweede generatie cefalosporinen (cefalexine, cefalonium, cefapirine) hebben een smal spectrum en zijn enkel effectief tegen gram positieve bacteriën. De nieuwere cefalosporinen (3e generatie: cefaperazon, ceftiofur; 4e generatie: cefquinome) zijn in toenemende mate ook effectief tegen gram negatieve bacteriën.
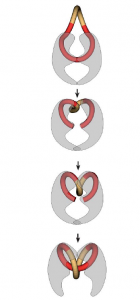
Polymyxinen verstoren de rigiditeit van de celwand van gram negatieve bacteriën door binding aan de lipopolysacchariden (LPS) die in de celwand van gram negatieve bacteriën voorkomen. Dit leidt tot een verminderde integriteit van de celwand en uiteindelijk sterfte van de bacterie. LPS is tevens een endotoxine en de binding van polymyxinen zorgt ook voor de neutralisatie hiervan.
Calcium en magnesium binden ook aan LPS en de aanwezigheid van deze ionen in het maagdarmkanaal zorgt dan ook, door middel van competitie, voor een verminderde effectiviteit van de polymyxinen. Fluoroquinolonen remmen de bacteriële synthese van DNA door het verhinderen van de transcriptie en translatie van DNA. Dit doen ze het remmen van de essentiële enzymen DNA-gyrase en topoïsomerase. Deze enzymen zorgen ervoor dat het DNA dat geproduceerd wordt in de zich vermenigvuldigende bacteriën opgerold kan worden. Hiervoor wordt het DNA gebonden aan een van deze enzymen, opengeknipt, gedraaid en weer gesloten. Dit wordt geïllustreerd in figuur 1. Fluoroquinolonen remmen deze enzymen door de vorming van een complex met zowel de DNA streng als het enzym. Naast het remmen van de DNA synthese en het herstel van DNA zorgt dit ook voor het vrijkomen van gebroken DNA-strengen. Dit zorgt weer voor oxidatieve stress voor de bacteriën. De combinatie van deze factoren zorgt ervoor dat fluoroquinolonen een bactericide werkingsmechanisme hebben.
Het spectrum van fluoroquinolonen verschilt per werkzame stof door een verschil in affiniteit voor de bacteriële enzymen. Flumequine is bijvoorbeeld alleen werkzaam tegen Enterobacteriaceae zoals E.coli en Salmonella spp. Door de toevoeging van een fluoridemolecuul kunnen fluoroquinolonen zoals enrofloxacine ook binden aan de enzymen van gram positieve bacteriën en anaeroben. Hierdoor wordt het spectrum breder en kunnen ook infecties veroorzaakt door onder andere Bordertella bronchiseptica, Manheima haemolytica, Pasteurella spp., Chlamydophila spp. en Actinobacillus pleuropneumoniae behandeld worden.
Lipofiliteit & Dissociatieconstante
Cefalosporinen en polymyxinen hebben een lage lipofiliteit en een klein verdelingsvolume. Dit resulteert in een slechte absorptie vanuit het maagdarmkanaal. Na parenterale toediening hebben cefalosporinen en polymyxinen wel een goede biologische beschikbaarheid en worden ze snel geabsorbeerd vanuit de injectieplaats. De membraanpassage blijft echter beperkt. Het bovenstaande verklaart waarom colistine, naast de parenterale toediening, met name ingezet wordt als behandeling van maagdarmaandoeningen. Polymyxine B wordt op zijn beurt voornamelijk ingezet voor de topicale behandeling van infecties. De cefalosporines worden parenteraal of intramammair toegediend.
Cefalosporinen hebben een lage pKa en kunnen dus accumuleren in weefsels met een pH die hoger is dan de pH van het plasma. Polymyxinen hebben juist een hoge pKa waardoor er accumulatie zal optreden in weefsels met een lagere pH dan de pH van het plasma.
Flumequine en vergelijkbare moleculen hebben een redelijk goede biologische beschikbaarheid. De nieuwe generatie fluoroquinolonen, waaronder enrofloxacine, hebben echter een zeer goede orale beschikbaarheid. Door de hoge lipofiliteit, het grote verdelingsvolume en de lage plasma-eiwitbinding bereiken deze nieuwere fluoroquinolonen bovendien hoge weefselconcentraties in onder meer de hersenen, darmen, lever en urinewegen. Fluoroquinolonen accumuleren in fagocyterende cellen, waarbinnen ze ook effectief zijn tegen intracellulaire bacteriën.
Voedsel vertraagt de absorptie van fluoroquinolonen vanuit het maagdarmkanaal door complexvorming met ionen. De AUC (area under the curve) en dus de biologische beschikbaarheid veranderen echter niet significant. Bij hoge concentraties magnesium of aluminium in het voer daalt de biologische beschikbaarheid van fluoroquinolonen wel drastisch.
Fluoroquinolonen zijn amfoteren. Dit betekent dat ze twee pKa’s hebben: één lage en één hoge pKa. Hierdoor zullen ze zich goed verdelen over zowel weefsels met een hogere als weefsels met een lagere pH dan de pH van het plasma.
Concentratie- of Tijdsafhankelijk effect
Cefalosporinen hebben een tijdsafhankelijk effect. De bacterie moet dus gedurende een voldoende lange periode in contact worden gebracht met het antibioticum. Voor een optimaal effect wordt het doseringsinterval zo bepaald dat dit interval niet langer is dan twee maal de periode waarin de weefselconcentratie hoger is dan de MIC. Deze periode moet per diersoort vastgesteld worden aan de hand van farmacokinetiekstudies.
Polymyxinen en fluoroquinolonen hebben een concentratie afhankelijk effect. Bij deze antibiotica is de blootstellingsduur minder belangrijk dan het bereiken van een hoge concentratie op de plaats van de infectie. Bij voorkeur wordt een piekconcentratie bereikt die tien maal hoger is dan de MIC.
Combineren van antibiotica
Daar cefalosporinen alleen effectief zijn in delende bacteriën kunnen cefalosporinen, evenals penicillines, niet gecombineerd worden met bacteriostatische antibiotica. De uitzondering op deze regel is de combinatie met aminoglycosiden, welke wel synergetisch is. Dit is reeds uitgelegd in de alinea over penicillines.
Polymyxinen kunnen gecombineerd worden met sulfonamiden en trimethoprim voor een synergetisch effect tegen verschillende Enterobacteriaceae, waaronder P.aeruginosa. Polymyxinen worden in de praktijk vaak gecombineerd met amoxicilline. Deze combinatie heeft een synergetisch effect bij de behandeling van infecties die veroorzaakt worden door een combinatie van bacteriën. Ook wordt deze combinatie ingezet om de ontwikkeling van resistentie tegen deze antibiotica te vertragen. Humaan wordt deze combinatie ook wel gebruikt om multiresistente bacteriën te behandelen, waaronder P.aeruginosa, E.coli en Enterobacter.
Fluoroquinolonen hebben een synergetisch effect wanneer ze gecombineerd worden met β-lactam antibiotica of aminoglycosiden.
Resistentie
De belangrijkste mechanismen waarop resistentie tegen cefalosporinen is gebaseerd zijn modificatie van de PBP’s, een verminderde permeabiliteit van de celwand, een toegenomen efflux en een enzymatische inactivatie door β-lactamases. Het laatste mechanisme is, evenals bij de penicillines, het belangrijkste. Meer informatie over de resistentie tegen β-lactam antibiotica kan gelezen worden in de alinea over penicillines. Hierbij moet wel opgemerkt worden dat nieuwere generaties cefalosporinen minder gevoelig zijn voor β-lactamases dan penicillinen en eerste generatie cefalosporinen. Het verschil in gevoeligheid wordt verklaard door een verandering van de structuur waardoor de β-lactamring zich op een andere plaats in het molecuul bevindt. Resistentie tegen cefalosporinen in Nederland wordt met name gezien bij gram positieve mastitisverwekkers (S.aureus, coagulase negatieve staphylococcen) bij het rund of B.bronchiseptica bij het varken.
Resistentie tegen polymyxinen komt nauwelijks voor. Als er resistentie optreedt is deze gebaseerd op een vermindering van het aantal LPS moleculen in de membraan of een verandering van de aanwezige LPS moleculen waardoor deze een andere lading krijgen. Door een verandering van de lading is de aantrekkingskracht op polymyxinen verminderd. De LPS moleculen komen bovendien dichter op elkaar te liggen, waardoor het voor polymyxinen lastiger wordt om zich aan deze moleculen te binden. Recent onderzoek heeft aangetoond dat plasmide gemedieerde resistantie gevonden kan worden in uit dieren geïsoleerde E.coli stammen. Voor deze groep antibiotica treedt een volledige kruisresistentie op; bacteriën die resistentie zijn tegen één polymyxine zijn dit ook voor de andere polymyxinen. In Nederland komt resistentie tegen colistine voor bij Salmonella spp. bij het rund.
Fluoroquinolonen remmen de werking van DNA-gyrase en topoïsomerase. Een van de functies van deze enzymen is de controle van DNA-strengen op het voorkomen van mutaties. Het remmen van deze enzymen zorgt dus voor een toename van het aantal mutaties in het bacteriële DNA. Vanzelfsprekend vergroot dit ook de kans op het optreden van mutaties die coderen voor resistentiemechanismen.
Resistentie tegen fluoroquinolonen ontstaat door een verandering van de bindingsplaats op de enzymen, een verminderde permeabiliteit, efflux pompen en/of het afschermen van de bindingsplaats. Een verminderde permeabiliteit wordt veroorzaakt door een vermindering van het aantal OMP (outer membrane proteins) poriën in de buitenmembraan van gram negatieve bacteriën. Als deze vorm van resistentie optreedt zal dit doorgaans ook leiden tot resistentie tegen andere antibiotica die ook gebruik maken van deze poriën zoals tetracyclines en β-lactam antibiotica.
Als bacteriën resistentie ontwikkelen tegen één van de fluoroquinolonen zijn ze doorgaans ook minder gevoelig voor andere fluoroquinolonen. Dit geldt met name voor de oudere moleculen en voor bacteriën die meerdere resistentiemechanismen ontwikkeld hebben. In Nederland worden regelmatig bacteriën geïsoleerd die resistent zijn tegen fluoroquinolonen. Enrofloxacineresistentie is bijv. bekend bij E.coli (rund) en Enterococcen spp. (pluimvee). Resistentie tegen flumequine komt voor bij zowel runderen (E.coli, Salmonella spp., M.haemolytica en Pasteurella spp.), kippen (E.coli) als varkens (B.bronchiseptica).
Diaminopyrimidinen & Sulfonamiden
Farmacodynamiek
Diaminopyrimidinen en sulfonamiden remmen de DNA-synthese van bacteriën door inhibitie van de foliumzuursynthese. Sulfonamiden interfereren met de eerste stap uit de foliumzuursynthese, de stap waarin para-aminobenzoëzuur (PABA) toegevoegd wordt aan dihydropteoaat-difosfaat. Sulfonamiden zijn structurele analogen van PABA en gaan in competitie voor het enzym dihydropteroaatsynthetase.
Diaminopyrimidinen interfereren later in het proces en veroorzaken een competitieve remming van het enzym dihydrofolaatreductase, waardoor voorkomen wordt dat dihydrofolaat omgezet kan worden in tetrahydrofolaat, de actieve vorm van foliumzuur.
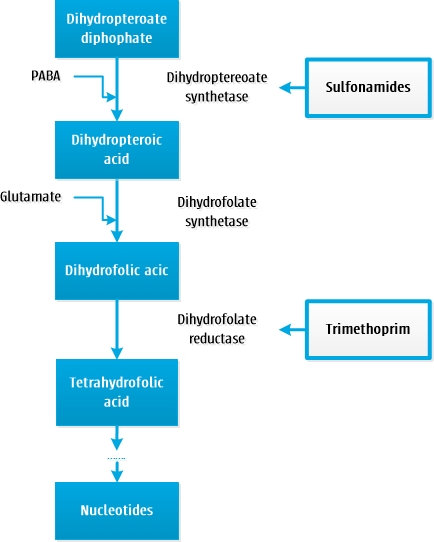
Sulfonamiden zijn bacteriostatisch, diaminopyrimidinen zijn dosisafhankelijk bactericide. De combinatie van deze antibiotica is bactericide. Zoals hierboven uitgelegd berust de werking van sulfonamiden op een competitieve binding met PABA. In een omgeving met een hoge concentratie PABA zullen sulfonamiden deze competitie niet winnen en als gevolg hiervan verminderd werkzaam zijn. Hoge concentraties PABA worden gevonden in ontstekingen met veel pus, necrose en/of debris. Dit verklaart waarom sulfonamiden in vivo soms onvoldoende werkzaam kunnen zijn ondanks een goede in vitro gevoeligheid.
Diaminopyrimidinen en sulfonamiden hebben een breed werkingsspectrum. Dit kan eenvoudig verklaard worden aangezien foliumzuur essentieel is voor de productie van DNA en RNA in bijna alle bacteriën. Slechts enkele Enterobacteriaceae zijn in staat om foliumzuur op te nemen uit hun omgeving, waardoor ze verminderd gevoelig zijn voor sulfonamiden.
Ook bij zoogdieren is de foliumzuursynthese van belang, met name tijdens de dracht. Alhoewel het bacteriële dihydrofolaatreductase vele malen gevoeliger is voor trimethoprim dan hetzelfde enzym dat bij zoogdieren, moeten deze antibiotica bij drachtige dieren terughoudend toegepast worden.
Lipofiliteit & Dissociatieconstante
Zowel sulfonamiden als diaminopyrimidinen hebben een matige lipofiliteit. De plasma-eiwitbinding van sulfonamiden is meestal hoog maar deze binding varieert enorm tussen verschillende sulfonamiden, maar ook tussen diersoorten. Diaminopyrimidinen hebben een matige plasma-eiwitbinding. Het verdelingsvolume van sulfonamiden is klein, maar ze verdelen zich doorgaans toch goed over weefsels waaronder synoviale en cerebrospinale vloeistoffen. Diaminopyrimidinen hebben een groter verdelingsvolume en komen in tegenstelling tot sulfonamiden ook intracellulair.
Ook de pKa van beide stoffen verschilt: sulfonamiden hebben een lagere pKa dan diaminopyrimidinen. Dit zorgt ervoor dat sulfonamiden zich ophopen in weefsels met een pH lager dan de pH van het plasma, terwijl diaminopyrimidinen ophopen in weefsels met een relatief hoge pH.
Eliminatie van zowel sulfonamiden als diaminopyrimidinen vindt voor een deel plaats door biotransformatie in de lever gevolgd door uitscheiding via de nieren, gal, melk en faeces. Daarnaast wordt een deel van deze antibiotica onveranderd uitgescheiden via de nieren. pH-verschillen van de urine zorgen voor een wisselende eliminatiesnelheid; bij een alkalische pH zal een groter deel van de sulfonamiden onveranderd uitgescheiden worden terwijl bij een zure pH een groter deel van de diaminopyrimidinen onveranderd uitgescheiden wordt. De snelheid van de biotransformatie is bij zowel sulfonamiden als diaminopyrimidinen verantwoordelijk voor variaties in de halfwaardetijd bij verschillende diersoorten.
Door het alkalische karakter van sulfonamiden kan het injecteren van deze antibiotica irriterend zijn. Sulfonamiden en TMP/S moeten daarom langzaam toegediend worden.
Ratio en halfwaardetijden
Bij het gebruik van combinatieproducten met trimethoprim en een sulfonamide wordt getracht in vivo een ratio te bereiken van 1 : 20, omdat trimethoprim ongeveer twintig keer potenter is dan de sulfonamiden. Humaan is aangetoond dat deze ratio het best bereikt kan worden door het toedienen van een geneesmiddel waar trimethoprim en sulfonamiden in voorkomen in een ratio van 1 : 5.
Tabel 1. Eliminatiehalfwaardetijden van trimethoprim en verschillende sulfonamiden bij runderen, kalveren, varkens en paarden na intraveneuze toediening (uur).
|
Rund |
Kalf |
Varken |
Paard |
| Trimethoprim |
1,0 – 2,0 |
1,9 – 2,1 |
2,7 – 2,9 2* |
2,0 – 3,0* |
| Sulfadiazone |
2,5 |
4,4 1 |
2,8 |
4,6 |
| Sulfamethoxazole |
2,3 |
12,8 * |
12,9 en 12,4 2 |
3,5 |
| Sulfachloorpyridazine |
1,2 |
13,1* |
3,0 4 |
3,8 |
| Sulfadoxine |
10,8 – 13,0 |
12,9 |
8,2 en 8,4 3 |
14,2 |
1 De eliminatiehalfwaardetijd bij kalveren daalt van 5,7 naar 3,6 tussen de leeftijd van 1 en 42 dagen.
2 Eliminatiehalfwaardetijden bij respectievelijk gezonde dieren en dieren met een pneumonie.
3 Eliminatiehalfwaardetijden bij toediening van respectievelijk sulfadoxine en sulfadoxine met trimethoprim.
4 Eliminatiehalfwaardetijen bepaald na orale toediening van sulfachloorpyridazine bij varkens.
* Toedieningsmethode wordt in de studie niet beschreven.
Omdat de eliminatiehalfwaardetijd van sulfonamiden varieert per werkzame stof en tussen diersoorten, komt de halfwaardetijd van de gebruikte sulfonamide niet altijd overeen met de halfwaardetijd van trimethoprim (zie tabel 1). Hierdoor zou de verhouding tussen trimethoprim en de sulfonamide slechts gedurende een korte periode overeenkomen met 1 : 20.
Ondanks het verschil in halfwaardetijden wordt er na toediening van combinatieproducten met trimethoprim en sulfonamiden doorgaans wel een goede effectiviteit waargenomen. Er zijn meerdere factoren die hierbij mogelijk een rol spelen. Ten eerste zorgt het grote verdelingsvolume van trimethoprim ervoor dat de concentraties in de weefsels hoger zijn dan de plasmaconcentraties en gedurende een langere periode gehandhaafd worden. Daarnaast is in vitro aangetoond dat het synergisme optreedt bij een bredere marge dan 1 : 20 (namelijk 1 : 1 tot 1 : 1000). Tot slot kan de farmacokinetiek bij een ziek dier of op de plaats van een ontsteking anders zijn dan bij gezonde dieren.
Concentratie- of Tijdsafhankelijk effect
Zowel sulfonamiden als diaminopyrimidinen hebben een tijdsafhankelijke werking. Dit betekent dat het belangrijk is dat de concentratie van deze antibiotica gedurende een zo lang mogelijke periode minimaal gelijk is aan de MIC (minimum inhibitory concentration) van de te behandelen bacterie.
Combineren van antibiotica
Diaminopyrimidinen en sulfonamiden worden vaak met elkaar gecombineerd om een bactericide effect te verkrijgen. Daarnaast kan de combinatie TMP/S in sommige situaties ook nog gecombineerd worden met andere antibiotica om het werkingsspectrum te verbreden naar zowel aërobe als anaërobe bacteriën, ook in situaties waar mogelijk pus of debris voorkomt. Dit kan onder andere bereikt worden door een combinatie met een penicilline.
Het combineren van TMP/S met andere diergeneesmiddelen in drinkwater wordt afgeraden. De combinatie van trimethoprim en sulfonamiden is moeilijk oplosbaar omdat trimethoprim oplost in een zuur milieu, terwijl sulfonamiden oplossen in een basisch milieu. Met hulpstoffen kan de oplosbaarheid vergroot worden, maar dit effect kan geneutraliseerd worden door andere diergeneesmiddelen of hulpstoffen die aan andere diergeneesmiddelen zijn toegevoegd.
Daarnaast kunnen sulfonamiden beter niet gecombineerd worden met procaïne (of procaïnepenicilline), omdat dit een analoog van PABA is en in competitie gaat met de sulfonamiden.
Resistentie
Resistentie tegen sulfonamiden wordt geregeld aangetoond bij bacteriën die geïsoleerd worden uit runderen, varkens en pluimvee, met name bij E.coli en bepaalde Salmonella species. Resistentie tegen sulfonamiden kan zowel chromosomaal als plasmidegebonden zijn en kan veroorzaakt worden door drie mechanismen:
- Verandering van het enzym dihydropteroaatsynthetase waardoor sulfonamiden niet meer kunnen binden;
- Verlaging van de intracellulaire concentratie door een verminderde permeabiliteit voor sulfonamiden;
- Productie van PABA waardoor de competitieve binding door sulfonamiden verloren zal gaan.
Bacteriën die resistent zijn tegen één sulfonamide, zijn ook resistent tegen andere sulfonamiden (volledige kruisresistentie). Multiresistentie is bekend waarbij bacteriën ook resistent zijn tegen andere antibiotica zoals trimethoprim of streptomycine. Dit wordt met name gezien bij plasmidegebonden resistentie.
Resistentie tegen diaminopyrimidinen is vaak gebaseerd op verandering van het enzym dihydrofolaatreductase waardoor de antibiotica hier niet meer aan kunnen binden, maar ook een verminderde permeabiliteit komt voor. Ook deze resistentie kan zowel chromosomaal als plasmidegebonden zijn.
Tetracyclines & Aminoglycosiden
Farmacodynamiek
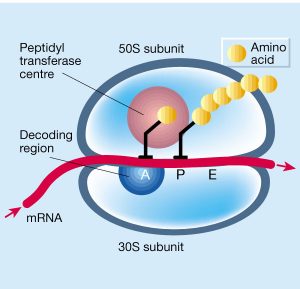
Tetracyclines en aminoglycosiden gaan een reversibele binding aan met de 30S subunit van het ribosoom. De 30S subunit van het ribosoom is de kleine subunit, welke verantwoordelijk is voor het decoderen van RNA zodat het ribosoom weet welke aminozuren ingebouwd moeten worden in het eiwit.
Tetracyclines interfereren in de eerste stap van dit proces; de binding van het tRNA aan het ribosoom. Het RNA kan dan niet afgelezen worden, en er kunnen dan geen aminozuren aan de eiwitketen toegevoegd worden. Omdat er geen eiwitten gevormd worden, kan de bacterie zich niet vermenigvuldigen. Dit leidt tot een bacteriostatisch effect.
Aminoglycosiden binden op een andere receptor van de subunit en zorgen ervoor dat het tRNA wel kan binden, maar verkeerd afgelezen wordt. De verkeerde aminozuren worden dan toegevoegd aan de eiwitketen. De verkeerd samengestelde eiwitten worden onder andere ingebouwd in de celwand, wat kan resulteren in een verstoring van de permeabiliteit en uiteindelijk lysis van de bacterie. Dit verklaart waarom aminoglycosiden in tegenstelling tot andere eiwitsyntheseremmers bactericide zijn.
Lipofiliteit & Dissociatieconstante
In de inleiding werd al beschreven dat lipofiliteit en de pKa belangrijk zijn voor het passeren van membranen. Voor de hier besproken antibiotica is dit erg belangrijk aangezien zij de celmembraan moeten passeren om het ribosoom te kunnen bereiken.
Tetracyclines hebben een matige lipofiliteit in combinatie en een groot verdelingsvolume. De absorptie uit het maagdarmkanaal is redelijk, maar tetracyclines zijn chelerende stoffen die binden aan voedsel. De aanwezigheid van voedsel in het maagdarmkanaal heeft dan ook een negatieve invloed op de absorptie. Door het grote verdelingsvolume zijn de weefselconcentraties doorgaans hoger dan de plasma concentraties. Tetracyclines bereiken met name goede concentraties in de longen en de uier, maar in de cerebrospinale vloeistof worden zelden werkzame concentraties bereikt door de matige lipofiliteit.
Doxycycline heeft een hogere lipofiliteit dan andere tetracyclines, waardoor de absorptie uit het maagdarmkanaal beter is en hogere concentraties bereikt worden in de weefsels. Aminoglycosiden hebben een lage lipofiliteit en een klein verdelingsvolume. Dit betekent dat de orale biologische beschikbaarheid slecht is en oraal toegediende aminoglycosiden met name effectief zijn in de darm. Na parenterale toediening wordt de verdeling vooral bepaald door de plasma-eiwitbinding; antibiotica die gebonden zijn aan plasma-eiwitten zullen de bloedvaten niet verlaten en zijn dus niet effectief. Omdat aminoglycosiden een lage plasma-eiwitbinding hebben bereiken ze na parenterale toediening wel werkzame concentraties in pericardiale, synoviale, pleurale, perilymfatische en peritoneale vloeistoffen. De diffusie naar gewrichten verbetert wanneer deze ontstoken zijn, omdat de pH in de gewrichten dan daalt en er ion trapping optreedt door de hoge pKa van aminoglycosiden. Aminoglycosiden bereiken de cerebrospinale vloeistof, evenals tetracyclines, in onvoldoende hoge concentraties om effectief te zijn.
Bij tetracyclines vindt de passage over de celmembranen plaats door diffusie, maar aminoglycosiden worden door gram negatieve bacteriën via een zuurstofafhankelijk proces actief de cel ingepompt. Dit verklaard waarom deze antibiotica niet effectief zijn onder anaerobe omstandigheden en bij (facultatief) anaerobe bacteriën. Daarnaast zijn aminoglycosiden verminderd werkzaam in een omgeving met veel purulent debris en lage pH waarden, zoals kan ontstaan bij weefselschade. Het debris bevat namelijk veel eiwitten, die kunnen binden aan de aminoglycosiden, waardoor deze de celmembraan van de bacteriën niet meer kunnen passeren en dus ineffectief zijn. Alhoewel drainage vaak om andere redenen wordt uitgevoerd, kan drainage bij een purulente ontsteking bijdragen aan een verbetering van de effectiviteit van het antibioticum.
Concentratie- of Tijdsafhankelijk effect
Aminoglycosiden hebben een concentratie-afhankelijke werkzaamheid en een lang postantibiotisch effect. Het is dus belangrijk een voldoende hoge dosering te bereiken op de plaats van de infectie, maar door het lange postantibiotische effect is het niet nodig om continu concentraties te bereiken die hoger zijn dan de MIC. Bovendien is het herhaald toedienen van aminoglycosiden binnen één dag een belangrijke risicofactor voor het optreden van nefrotoxiciteit. Aminoglycosiden worden renaal uitgescheiden en accumuleren in de tubuluscellen, waar ze toxiciteit kunnen veroorzaken. Accumulatie, en dus de toxiciteit, is met name afhankelijk van de duur van de blootstelling en is minimaal bij een korte piekconcentratie. De combinatie van deze twee factoren leidt ertoe dat aminoglycosiden steeds vaker slechts één keer per dag toegediend worden.
Renale accumulatie is tevens de oorzaak van de lange wachttijd die gehanteerd dient te worden na het gebruik van aminoglycosiden. Tetracyclines hebben geen specifieke concentratie- of tijdsafhankelijke werking. Zowel de concentratie als de duur van blootstelling zijn van belang.
Combineren van antibiotica
In bepaalde situaties kan het zinvol zijn antibiotica te combineren, bijvoorbeeld voor het verbreden van het spectrum. Eiwitsyntheseremmers kunnen echter niet gecombineerd worden met β-lactam antibiotica, zoals penicillinen. β-lactam antibiotica zijn voor hun effectiviteit namelijk afhankelijk van het delen van de bacteriën, wat niet zal gebeuren na het toedienen van eiwitsyntheseremmers. Aminoglycosiden vormen hier echter een uitzondering op. Door het gebruik van β-lactam antibiotica wordt de wand meer permeabel voor aminoglycosiden. Bovendien zijn aminoglycosiden, als enige binnen de groep van eiwitsyntheseremmers, bactericide. Deze combinatie kan leiden tot een synergetisch effect tegen Streptococcen spp., Enterococcen spp., Pseudomonas spp. en andere gram negatieve bacteriën.
Resistentie
Door het wijd verspreide gebruik van tetracyclines wordt resistentie gevonden bij zowel rundvee, varkens als pluimvee. Er zijn verschillende mechanismen waarop resistentie tegen tetracyclines zich kan ontwikkelen:
- Verandering of afscherming van het aangrijpingspunt op het ribosoom
- Verlaging van de intracellulaire concentratie van het antibioticum
- Dit kan bereikt worden door effluxpompen; deze energieafhankelijke pompen wisselen een proton uit tegen een complex van een tetracycline met een kation.
- Ook kan er een daling optreden van de productie van het OmpF porine. Dit is de structuur waardoor tetracyclines de buitenste membraan van de bacterie passeren.
- Enzymatische inactivering van antibiotica (met name bij Enterobacteriaceae)
Verandering van het ribosoom en het gebruik van effluxpompen zijn de belangrijkste mechanismen. Kruisresistentie is binnen deze groep antibiotica regel; resistentie tegen één antibioticum uit deze groep leidt ook tot resistentie tegen andere tetracyclines. Ook tegen aminoglycosiden bestaat er in de praktijk resistentie. Resistentie tegen aminoglycosiden wordt met name gerealiseerd door enzymatische inactivering van het antibioticum, maar ook de andere resistentiemechanismen die hierboven voor tetracyclines genoemd zijn, zijn bekend voor aminoglycosiden. Kruisresistentie bij aminoglycosiden is zeer onvoorspelbaar; in veel gevallen is de bacterie nog wel gevoelig voor een ander aminoglycoside, maar dit moet op voorhand getest worden.
Macroliden, Lincosamiden, Pleuromutilinen en Fenicolen
Farmacodynamiek
De antibiotica uit de groepen macroliden, lincosamiden, pleuromutilinen en fenicolen gaan een reversibele binding aan met de 50S subunit van het ribosoom. De 50S subunit is de grote subunit en is verantwoordelijk voor het samenvoegen van de verschillende aminozuren zodat deze één keten (peptide) vormen. Dit is met name afhankelijk van het e nzym peptidyltransferase.
Zowel de lincosamiden, de pleuromutilinen als de fenicolen remmen de werking van het bovengenoemde enzym peptidyltransferase. Hierdoor worden de aminozuren niet samengevoegd tot één keten (peptide) voordat ze het ribosoom verlaten. Macroliden hebben een enigszins ander werkingsmechanisme; zij zorgen ervoor dat de gevormde eiwitketen wordt losgelaten voordat deze afgerond is. In de aanwezigheid van macroliden worden dus alleen korte en incomplete eiwitketens gevormd, terwijl er bij de aanwezigheid van een antibioticum uit één van de andere groepen helemaal geen eiwitketens worden gevormd.
Deze antibiotica worden doorgaans geclassificeerd als bacteriostatisch. In sommige gevallen is het effect echter bactericide. Dit is afhankelijk van de concentratie van het antibioticum, de periode waarin de concentratie hoger is dan de MIC, de bacteriestam die behandeld wordt en de hoeveelheid bacteriën. Voor florfenicol is een bactericide effecta aangetoond tegen Actinobacillus pleuropneumoniae en Pasteurella multocida, wanneer de concentratie van florfenicol gedurende 12 uur hoger was dan de MIC.
Naast het bacteriostatische antibacteriële effect worden macroliden en lincosamiden ook wel eens genoemd als immunomodulerende diergeneesmiddelen. Er zijn verschillende manieren waarop deze antibiotica een effect hebben op het verloop van een infectie; ze beïnvloeden zowel de bacterie en de interactie tussen de bacterie en de gastheer als het immuunsysteem van de gastheer. Deze effecten worden echter alleen verkregen door die macroliden die een 14- of 15-ledige lactonring bezitten. Hiervan wordt alleen erythromycine veterinair toegepast. Bovendien moeten deze antibiotica voor het verkrijgen van dit effect gedurende een lange periode in een lage concentratie toegediend worden, wat niet past binnen het kader verantwoord antibioticumgebruik.
Verder is door middel van onderzoek aangetoond dat tilmicosine ook effectief is bij PRRS infecties. In vitro studies beschrijven een daling van de virusconcentratie in cellijnen, terwijl in vivo studies een daling van de mortaliteit, het aantal longlaesies en de virustiters in de longen en het serum laten zien. Dit effect wordt mogelijk verklaard door de ophoping van tilmicosine in de macrofagen, waar ze vermeerdering van het virus voorkomen.
Lipofiliteit & Dissociatieconstante
Het passeren van membranen is voor deze groep antibiotica erg belangrijk, omdat het aangrijpingspunt (ribosoom) zich in de bacterie bevindt. Zoals eerder beschreven, zijn hiervoor de lipofiliteit en de pKa van belang. De antibiotica die binden aan de 50S subunit van het ribosoom hebben een matige tot hoge lipofiliteit met een hoge pKa. Door de goede lipofiliteit zijn ze in staat biologische membranen, waaronder de celmembraan, te passeren. Door de hoge pKa van deze antibiotica zal ion trapping optreden in organen met een pH die lager is dan de pH van het plasma (o.a. longen, uier). Ook zal ion trapping optreden in ontstoken weefsels, omdat ook hier de pH van het weefsel lager is dan de pH van het plasma.
Door het grote verdelingsvolume van deze antibiotica zullen in de weefsels vaak concentraties bereikt worden die hoger zijn dan de serumconcentraties. De biologische beschikbaarheid is goed na zowel orale als parenterale toediening. Tulathromycine is een semisynthetische macrolide met een specifieke farmacokinetiek. Onderzoek heeft aangetoond dat dit antibioticum bij varkens na intraveneuze of intramusculaire toediening een hoge en homogene concentratie bereikt in de longen, welke bovendien gedurende een lange periode behouden blijft. Ook voor andere diersoorten zoals rundvee, paarden en geiten is aangetoond dat tulathromcyine bij deze diersoorten vergelijkbare farmacokinetische eigenschappen heeft.
Concentratie- of Tijdsafhankelijk effect
Macroliden, lincosamiden, pleuromutilinen en fenicolen zijn tijdsafhankelijke antibiotica. Het is dus belangrijk om op de plaats van de infectie gedurende een voldoende lange periode concentraties te bereiken die minimaal even hoog zijn als de MIC. Een continue dosering heeft daarom ook de voorkeur boven een pulsdosering.
Combineren van antibiotica
Het wordt afgeraden om antibiotica uit deze groep te combineren met β-lactam antibiotica. Het effect van deze groep antibiotica wordt wel omschreven als zowel bacteriostatisch als bactericide, maar het effect zal zeker gedurende een deel van de tijd bacteriostatisch zijn. De groei van bacteriën wordt dan geremd, waardoor de β-lactam antibiotica hun werkzaamheid verliezen daar deze alleen effectief zijn tegen zich delende bacteriën.
Ook met het combineren van verschillende antibiotica uit deze groep moet men voorzichtig zijn. Zowel macroliden, lincosamiden, pleuromutilinen en fenicolen moeten kunnen binden aan de 50S subunit om effectief te zijn. De bindingsplaatsen van macroliden, lincosamiden en fenicolen overlappen elkaar gedeeltelijk. Het combineren van deze antibiotica met elkaar wordt daarom afgeraden.
Een combinatie met tetracyclines of aminoglycosiden is wel mogelijk, omdat deze op de andere subunit van het ribosoom binden.
Tot slot moet er bij het combineren van deze antibiotica rekening worden gehouden met het feit dat ze het enzymsysteem CYP-450 (cytochroom P450) in de lever remmen. Remming van deze enzymen door antibiotica zorgt ervoor dat het antibioticum zelf, maar ook andere diergeneesmiddelen (fluoroquinolonen, ionoforen), vertraagd worden gemetaboliseerd. Een relatieve overdosering kan dan het gevolg zijn.
Resistentie
Resistentie tegen macroliden, pleuromutilinen en lincosamiden bij gramnegatieve bacteriën is doorgaans gebaseerd op een verminderde permeabiliteit van de celmembraan. In grampositieve bacteriën wordt resistentie tegen deze antibiotica vaak veroorzaakt door verandering van het aangrijpingspunt, actieve efflux van de antibiotica en enzymatische inactivering van de antibiotica. Deze resistentiemechanismen komen ook in mindere mate voor bij gramnegatieve bacteriën.
Wanneer resistentie veroorzaakt wordt door modificatie van het aangrijpingspunt treedt vaak kruisresistentie op tussen macroliden, lincosamiden en streptogramin B. Dit wordt verklaard door de overlappende bindingsplaatsen van deze antibiotica. Dit resistentiemechanisme is ook bekend als MLSB resistentie. Resistentie tegen fenicolen is in de meeste gevallen gebaseerd op enzymatische inactivering van het antibioticum. Efflux systemen zijn echter ook bekend. Bij gramnegatieve bacteriën wordt soms ook een verminderde permeabiliteit of een transporter gevonden die effectief is tegen verschillende antibiotica (multiresistente bacteriën).
Referenties
- Altenburg, J., de Graaf, C.S., van der Werf, T.S., Boersma, W.G. (2011) Immunomodulatory effects of macrolide antibiotics – Part 1: Biological mechanisms. Respiration, 81: 67-74.
- Baert, K., de Baere, S., Croubels, S., Gasthuys, F., de Backer, P. (2001) Pharmacokinetics and bioavailability of sulfadiazine and trimethoprim (trimazin 30%) after oral administration in non-fasted young pigs. J Vet Pharmacol Therap 24: 295-298.
- Barberio, A., Badan, M., Bonamico, S., Mancin, M., Simonato, G., Parolin, O. Bazzim, D. (2012) Use of aminosidine sulphate to prevent cryptosprodiosis in calves. Review of Veterinary Medicine 47.
- Benchaoui, H.A., Nowakowski, M., Sherington, J, Rowan, T.G., Sunderland, S.J. (2004) Pharmacokinetics and lung tissue concentrations of tulathromycin in swine. J.Vet.Pharmacol.Therap 27: 203-210.
- Bleyen, N., de Gussem, K., Nguyen, A.D., Ons, E., van Gerven, N. Goddeeris, B. (2009) Non-curative, but prophylactic effects of paromomycin in Histomonas meleagridis-infected turkeys and its effect on performance in non-infected turkeys. Research paper, University of Leuven, Belgium.
- Brouwers, J.R.B.J. (1987) Pharmacokinetics of the newer fluoroquinolones. Pharmaceutisch Weekblad Scientific Edition (Supplement) 9: S16-S22.
- Brown, M.P., Gronwall, R., Castro, L. (1988) Pharmacokinetics and body fluid and endometrial concentrations of trimethoprim-sulfamethoxazole in mares. Am J Vet Res 49: 918-922.
- Centre for food security & Public health – Iowa state university (2011) Methicillin resistant Staphylococcus aureus.
- The Centre for Food Security and Public Health (2011) Methicillin resistant Staphylococcus aureus Factsheet.
- Du, Y., Yoo, D., Paradis, M-A, Scherba, G. (2011) Antiviral activity of tilmicosine for type 1 and type 2 porcine reproductive and respiratory syndrome virus in cultured porcine alveolar macrophages. Antivir Antiretrovir 3: 28-33.
- Formuarlium melkvee, werkgroep veterinair antibioticumbeleid KNMvD. Versie 1.1 (2012), aangepast op 02-01-2014.
- Giguere, S., Prescott, J.F., Baggot, J.D., Walker, R.D., Dowling, P.M. (2007) Antimicrobial therapy in veterinary medicine, fourth edition. Blackwell publishing, 121-137, 179 – 188, 191 – 205, 207 – 229, 231-262.
- Guardabassi, L., Jensen, L.B., en Kruse, H. (2008) Guide to Antimicrobial Use in Animals. Blackwell Publishing.
- Gustafsson, A., Baverud, V, Franklin, A., Gunnarsson, A., Ögren, G., Ingvast-Larsson, C. (1999) Repeated administration of trimethoprim/sulfadiazine in the horse-pharmacokinetics, plasma protein binding and influence on the intestinal microflora. J Vet Pharmacol Therap 22: 20-26.
- Hamilton-Miller, J.M.T. en Shah, S. (1999) Effect of antibiotic concentration on the killing of Staphylococcus aureus and Enterococcus faecalis: Comparison of the novel penem, Men 10700 , with other β-lactam antibiotics. J Antimicrob Chemother 44: 418-420.
- He, J., Tang, S., Li, L., Zhang, C., Li, X., Xia, X., Xiao, X. (2010) Pharmacokinetics of a novel amoxicillin/colistin suspension after intramuscular administration in pigs. J Vet Pharmacol Therap 34: 42-50.
- Joint scientific report of ECDC, EFSA and EMEA on methicillin resistant Staphylococcus aureus (MRSA) in livestock, companion animals and food.
- Kaartinen, L., Gips, M., Laurila, T., Härtel, H., Soback, S., Pyörälä (2000) Pharmacokinetics of sulphadoxine and trimethoprim and tissue irritation caused by two sulphadoxine-trimethoprim containing products after subcutaneous administration in pre-ruminant calves. Vet Res. 31: 517-526.
- Kaartinen, L., Löhönen, K., Wiese, B., Franklin, A., Pyörälä, S (1999) Pharmacokinetics of sulphadiazine-trimethoprim in lactating dairy cows(abstract). Acta Vet Scand 40: 271-278.
- Kwiatkowska, B., Maslinska, M., Pryzgodzka, M., Dmowksa-Chalaba, J., Dabrowska, J., Sikorska-Siudek, K. (2013) Immune system as a new therapeutic target for antibiotics. Advances in Bioscience and Biotechnology, 4: 91-101.
- Leclercq, R., Courvalin, P. (2002) Resistance to macrolides and related antibiotics in Streptococcus pneumoniae.Antimicrobial agents and chemotherapy 46: 2727-2734.
- Melchior, M., Van Hout-van Dijk, J. (2011) Antibiotica, van werkingsmechanismen naar antibacteriële therapie. Deel III (van IV). Tijdschrift voor Diergeneeskunde 136(9): 646-652.
- Mengelers, M.J.B., van Gogh, E.R., Kuiper, H.A,. Pijpers, A., Verheijden, J.H.M., van Miert, A.S.J.P.A.M. (1995) Pharmacokinetics of sulfadimethoxine and sulfamethoxazole in combination with trimethoprim after intravenous administration to healthy and pneumonic pigs. J Vet Pharmacol Therap 19: 243-253.
- Monitoring jaarverslag 2012, Gezondheidsdienst voor dieren te Deventer.
- Nielsen, P., Rasmussen, F. (1975) Trimethoprim and sulphadoxine in swine; Half-lives, volume of distribution and tissue concentration. Zbl Vet Med A 22: 564-571.
- Nielsen, P., Rasmussen, F. (1977) Half-life, apparent volume of distribution and protein-binding for some sulphonamides in cows. Research in Veterinary Science 22: 205-208.
- Nielsen, P., Romvary, A., Rasmussen, F. (1978) Sullphadoxine and trimethoprim in goats and cows: absorption fraction, half-lives and the degrading effect of the ruminal flora. J Vet Pharmacol Therap 1: 37-46.
- Openstax CNX, Probiotic diversity. (bron voor afbeelding).
- Pankey, G.A., Sabath, L.D. (2004) Clinical Relevance of Bacteriostatic versus Bactericidal Mechanism of Action in the Treatment of Gram-Positive Bacterial Infections. Clinical Infectious Disease 38; pp 864-870.
- Plumb, D.C. (2011) Plumb’s Veterinary Drug Handbook, 7thedition. Wiley-Blackwell.
- Quintiliani, R. Pharmacodynamics of Antimicrobial Agents: Time-Dependent vs. Concentration-Dependent Killing.
- Rasmussen, F., Gelsa, H., Nielsen, P., Pharmacokinetics of sulphadoxine and trimethoprim in horses. Half-life and volume of distribution of sulphadoxine and trimethoprim and cumulative excretion of [14C]-trimethoprim. J Vet Pharmacol Therap 2: 245-255.
- Rolinski, Z., Duda, M. (1984) Pharmacokinetic analysis of the level of sulfonamide-trimethoprim combination in calves(abstract). Pol J Pharmacol Pharm 36: 35-40.
- Romvary, A., Horvay, A. (1976) Data on the pharmacokinetics of sulfonamid-trimethoprim combinations in sucking pigs. Zbl Vet Med 23: 781-792.
- Schwarz, S. Chaslus-Dancla, E. (2001) Use of antimicrobials in veterinary medicine and the mechanisms of resistance. Vet Res 32: 201-225.
- Shoaf, S.E., Schwark, W.S., Guard, C.L. (1989) Pharmacokinetics of sulfadiazine/trimethoprim in neonatal male calves: effect of age and penetration into cerebrospinal fluid (abstract). Am J Vet Res 50: 396-403.
- Shoaf, S.E., Schwark, W.S., Guard, C.L., Swartsman, R.V. (1986) Pharmacokinetics of trimethoprim/sulfadiazine in neonatal calves: influence of synovitis. J Vet Pharmacol Therap 9: 446-454.
- van Duijkeren, E., Vulto, A.G., Sloet van Oldruitenborgh, M.M., Kessels, B.G., van Miert, A.S., Breukink, H.J. (1995) Pharmacokinetics of trimethoprim/sulfachlorpyridazine in horses after oral, nasogastric and intravenous administration. J Vet Pharmacol Ther 18: 47-53.
- Van Hout-van Dijk, J. en Melchior, M. (2011) Antibiotica; van werkingsmechanismen naar antibacteriële therapie. Deel I (van IV). Tijdschrift voor Diergeneeskunde 136: 494-499.
- Van Hout-van Dijk, J. en Melchior, M. (2011) Antibiotica; van werkingsmechanismen naar antibacteriële therapie. Deel II (van IV). Tijdschrift voor Diergeneeskunde 136(8): 572-577.
- Van Hout-van Dijk, J. en Melchior, M. (2011) Antibiotica; van werkingsmechanismen naar antibacteriële therapie. Deel III (van IV). Tijdschrift voor Diergeneeskunde 136: 646-652.
- Van Hout-van Dijk, J. en Melchior, M. (2011) Antibiotica; van werkingsmechanismen naar antibacteriële therapie. Deel lV (van IV). Tijdschrift voor Diergeneeskunde 136(10): 730-733.
- Villarino, N., Brown, S.A., Martin-Jiménez (2013) Understanding the pharmacokinetics of tulathromycin: a pulmonary perspective. Vet. Pharmacol. Therap. 37: 211-221.
- Villarino, N., Lesman, S., Fielder, A., Garciá-Tapia, D., Cox, S., Lucas, M., Robinson, J., Brown, S.A., Martin-Jiménez, T. (2012a) Pulmonary pharmacokinetics of tulathromycin in swine. Part I: Lung homogenate in healthy pigs and pigs challenged intratracheally with lipopolysaccharide of Escherichia coli. Vet. Pharmacol. Therap 36: 329-339.
- Villarino, N., Lesman, S., Fielder, A., Garciá-Tapia, D., Cox, S., Lucas, M., Robinson, J., Brown, S.A., Martin-Jiménez, T. (2012b) Pulmonary pharmacokinetics of tulathromycin in swine. Part 2: Intra-airways compartments. J. Vet. Pharmacol. Therap 36: 340-349.
- Viu, M., Quilez, J., Sanchez-Acedo, C., del Cacho, E., Lopez-Bernad, F. (2000) Field trial on the therapeutic efficacy of paromomycin on natural Cryptosporidium parvum infection in labms. Zoot. Vet. 28: 13-19.
- Vologodskii, A. (2004) Computational analysis of DNA gyrase action. Biophysical journal 87: 3066-3073.
- Williamson, J.R. (2000) Small subunit, big science. Molecular biology. Nature 407: 306-307.










 Corticosteroïden, waaronder triamcinolonacetonide, methylprednisolonacetaat, betamethason en dexamethason, vallen onder stoffen die verboden zijn op racedagen. Het gebruik van deze middelen is wel toegestaan voor de behandeling van gediagnostiseerde en geïndiceerde aandoeningen tijdens training. Het is de verantwoordelijkheid van de trainer om te zorgen dat er op de racedag geen verboden stoffen in het paard aanwezig zijn.
Corticosteroïden, waaronder triamcinolonacetonide, methylprednisolonacetaat, betamethason en dexamethason, vallen onder stoffen die verboden zijn op racedagen. Het gebruik van deze middelen is wel toegestaan voor de behandeling van gediagnostiseerde en geïndiceerde aandoeningen tijdens training. Het is de verantwoordelijkheid van de trainer om te zorgen dat er op de racedag geen verboden stoffen in het paard aanwezig zijn.
