Parasitaire infecties worden beschouwd als een belangrijk en veel voorkomend probleem in relatie tot diergezondheid, met name voor grazende herkauwers. Bij inwendige parasieten denken we als dierenarts dan voornamelijk aan maagdarmwormen, longwormen en leverbot. Aan paramphistomen of pensbotten denken we zelden of nooit. Desondanks komen deze platwormen, die zich nestelen in de pens bij graseters, wereldwijd voor. Waar ze voorheen vooral in tropische en subtropische gebieden voor ziekte bij herkauwers zorgden, lijkt het erop dat besmettingen in West-Europa vaker voorkomen dan we denken. Meningen zijn verdeeld over de invloed van deze parasieten op diergezondheid en technische resultaten.

Paramphistomen
Paramphistomose, een infectie veroorzaakt door een parasiet van het genus Paramphistomum is al sinds jaar en dag bekend. Waar paramphistomose voordien altijd beschreven werd als een ziekte die voornamelijk in tropische gebieden voorkwam, zien we dat de laatste jaren de prevalentie ook stijgt in West-Europa (Huson et al., 2017). Van de verschillende Paramphistomum species wordt Calicophoron daubneyi (vroeger Paramphistomum daubneyi) het meest aangetroffen in Europa. In Frankrijk, Groot-Brittannië, Ierland, België, Portugal en Spanje is er een enorme toename van voorkomen van deze parasiet gezien en wijst men op het belang van eventuele controlemaatregelen (Malrait et al., 2015). Ook in Nederland werd bij het routinematig onderzoek van alle door de GD ontvangen mestmonsters in de periode 2009-2014, een incidentie van 15,8% bij runderen en 8% bij schapen gerapporteerd (H.W. Ploeger, 2017).
Verspreiding door aankoop van besmette dieren over de continenten heen, verbeterde diagnostische methoden zoals mestonderzoek door een gemodificeerde McMastertechniek, klimatologische veranderingen met verhoogde regenval en verhoogde temperaturen, overschakeling naar meer gerichte behandelingen tegen leverbot (en niet effectief tegen pensbot) werden allemaal gesuggereerd als mogelijke redenen voor de stijgende prevalentie. Uit een recent onderzoek op basis van de deep amplicon sequencing methode, uitgevoerd door de universiteit van Edinburgh is gebleken hoe groot de impact van intensieve verplaatsingen van dieren is op de verspreiding van de infectie (Sargison et al., 2019). Op basis van dit resultaat dringt een goede parasietbestrijding zich op, naast natuurlijk preventieve maatregelen zoals bestrijding van de tussengastheer door waterpeilverlaging.
Levenscyclus
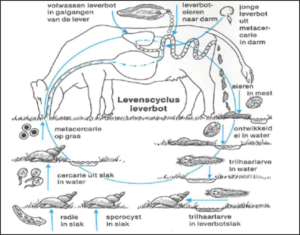
De levenscyclus van de pensbot Calicophoron daubneyi vertoont vele gelijkenissen met deze van de leverbot Fasciola hepatica. Naast dezelfde eindgastheer heeft de pensbot ook een indirecte cyclus, waarbij de zoetwaterslak / modderslak Galba Truncatula tussengastheer is (Kaufmann et al., 1996).
Maar er zijn ook duidelijke verschillen tussen de twee trematoden. Na opname van de besmettelijke metacercaria door de eindgastheer komen de geëxcysteerde larven vrij in de lebmaag om dan richting het duodenum te migreren. Daar hechten ze zich vast aan de mucosa waar ze zich verder ontwikkelen gedurende een 3 tot 6-tal weken. Aanwezigheid en migratie in de dunne darm kan aanleiding geven tot het berokkenen van behoorlijk wat schade. Zo kunnen de immature stadia grote stukken intestinale darmwand opnemen en daarbij necrose veroorzaken (Hendrix et al., 2006). Nadat de pensbot volledig is uitgegroeid, migreert de parasiet terug naar de pens en netmaag waar hij zich vasthecht aan de penspapillen. Na enkele weken aanwezig te zijn in de pens en netmaag is de volwassen pensbot in staat om eieren te produceren. Deze komen met de mest op de weide terecht. Alleen in een waterig milieu en als de temperatuur boven de 10 ˚C is komen uit het ei miracidia. In de buitenwereld hebben deze miracidia een maximale levensduur van 24 uur. Gedurende die tijd gaan ze op zoek naar de tussengastheer Galba Truncatula. Na enkele ontwikkelingen in de tussengastheer worden de cercaria uitgescheiden. De vrijgekomen cercaria encysteren al vrij vlug op een voor hen geschikte plaats (zoals gras in de buurt van water) tot metacercaria. Bij een gematigd klimaat kunnen zij tot 6 maanden overleven. De eindgastheer wordt besmet door het opeten van het gras waarop de metacercaria zich bevinden.
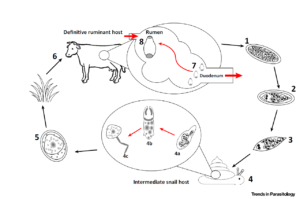
Levenscyclus van de pensbot, Calicophoron daubneyi (Huson et al., 2017)
Symptomen
Er kan een onderscheid gemaakt worden tussen de symptomen veroorzaakt door enerzijds de immature en anderzijds de volwassen stadia in de eindgastheer.
Paramphistomose kan zich op twee manieren manifesteren in het rund:
Acute vorm veroorzaakt door de immature stadia
De migratie van de juveniele pensbotten en de migratie in de mucosa van de dunne darm kunnen verantwoordelijk zijn voor de vernietiging van de spijsverteringsklieren. Al vrij vlug na besmetting met pensbot is er erosie van het darmepitheel met hemorragisch letsel en slijmvliesoedeem te zien. De acute hemorragische enteritis die hieruit ontstaat, kan gepaard gaan met flinke diarree, verminderde eetlust, dehydratatie, gewichtsverlies, anorexie en zelfs sterfte. Herinfectie van dieren gaat dikwijls gepaard met overgevoeligheidsreacties type 1 welke de ernst van symptomen kunnen vergroten.
Chronische vorm veroorzaakt door adulte stadia
Relatief milde manifestaties van volwassen wormen in de pens geven zelden aanleiding tot klinische symptomen.
Massale hoeveelheden pensbotten daarentegen, bij voorkeur gegroepeerd ter hoogte van de penspijlers, kunnen aanleiding geven tot meteorisme, ruminale pensatrofie en oedeemvorming ter hoogte van de mucosaplooien van de pens. Dit kan gepaard gaan met slappere mest en verminderde eetlust.
Histopathologisch onderzoek op besmette koeien heeft aangetoond dat er een correlatie bestaat tussen de hoeveelheid pensbotten en pensbeschadigingen zoals hyperkeratose en infiltratie van ontstekingscellen (Fuertes et al., 2015). Of echter de aanwezigheid van pensbotten een significant effect heeft op gezondheid, groei en prestatie van de eindgastheer is maar de vraag. Daarentegen werd dan weer in een studie op slachthuisniveau een duidelijke negatieve associatie aangetoond tussen een pensbotinfectie en het karkasgewicht en de vetbedekking van het dier (Bellet et al., 2016).
Immuniteitsopbouw
De meeste parasieten induceren een bepaalde graad van immuniteit bij hun eindgastheer, waardoor er een evenwicht ontstaat tussen de parasitaire populatie en de gastheer. Of dit fenomeen ook geldt voor infestaties met trematoden is nog niet honderd procent duidelijk. Volgens Chauvin et al, 2012 is dit voor pensbot niet helemaal het geval. Ook Ferreras et al 2014 suggereert dat herhaalde blootstelling aan pensbotten geen bescherming biedt tegen herinfectie. Zo kunnen herhaaldelijke zware infecties met pensbotten leiden tot accumulatie van het aantal pensbotten.
In haar onderzoek daarentegen geeft Knubben-Schweizer aan dat opeenvolgende kleine infecties bij oudere dieren een gedeeltelijke immuniteit opleveren.
Diagnose
Klinische symptomen zijn meestal niet erg specifiek en zullen dus geen duidelijke diagnose kunnen geven.
Als in de anamnese gesproken wordt over dieren uit vaak overstroomde graasgebieden met ernstige diarree, dan moet bij de diagnose zeker rekening gehouden worden met een eventuele infectie met pensbot.
Mestonderzoek
De aanwezigheid van volwassen wormen (eierproducerende stadium) kan tot op heden alleen door mestonderzoek aangetoond worden.
Er kan een onderscheid gemaakt worden tussen kwalitatief en kwantitatief fecesonderzoek. Bij routineonderzoeken is kwalitatief onderzoek meestal voldoende. Hierbij wordt nagegaan of een dier al dan niet besmet is.
Om een goed beeld te verkrijgen van de infectiegraad kan men beter een kwantitatieve bepaling doen. Hierbij kan onder meer het aantal eieren per gram feces (= EPG) worden bepaald (Vercruysse, 1992). Eén van de kwantitatieve methoden die gebruikt wordt om de EPG te bepalen van verschillende soorten parasieten is de McMastermethode. Deze methode maakt hiervoor gebruik van een telkamer. Vermits de eieren van treamatoden vrij zwaar zijn moet er gebruik gemaakt worden van flotatievloeistoffen met een soortelijk gewicht boven 1,35.
Rieu et al. (2007) onderzochten de mate van betrouwbaarheid van mestonderzoek bij pensbot. Er werd een significante relatie tussen EPG-tellingen en de ernst de van infectie gevonden. Het vinden van meer dan 100 eieren per gram mest gaf een indicatie dat er zich meer dan 100 adulte paramphistomen in de pens of netmaag bevonden.
In de masterproef van Karen Malrait aan de UGent werd een cut-off waarde van 200 EPG gebruikt om een zware infectie (met meer dan 201 volwassen pensbotten in de pens) te onderscheiden van lichtere infecties. De hoeveelheid eieren in de feces zegt echter niets over de pathogeniteit van de infectie vermits symptomen voornamelijk door de immature stadia worden veroorzaakt.
Bij immature stadia kan mestonderzoek aanleiding geven tot een vals negatief resultaat. Immature stadia scheiden immers nog geen eieren uit. Wat wel kan voorkomen is dat bij erg geïnfecteerde dieren rode immature pensbotten in mest te vinden zijn.
Necroscopie
Necroscopie op dode dieren kan aardig wat informatie opleveren.
Bij de acute vorm van de infectie onthult het openen van de darm de aanwezigheid van rode immature pensbotten van één tot twee millimeter afhankelijk van hun stadium van ontwikkeling, kleine oppervlakkige zweertjes en oedeem van de mucosa.
Bij de chronische vorm zie je bij het openen van de pens de volwassen parasieten aan de wand hangen.
Er zijn volop ontwikkelingen aan de gang van onderzoeken naar serologische en moleculaire technieken, die mogelijk in de toekomst kunnen leiden tot verbeterde diagnostiek.
Behandeling
Net als bij een leverbotinfectie berust de bestrijding op twee pijlers.
Preventie
Een doordacht weidebeheerplan waarmee ervoor gezorgd wordt dat koeien niet in drassige gebieden kunnen vertoeven is één van de belangrijkste dingen die uitgevoerd kunnen worden. Ook jonge gevoelige dieren niet laten grazen met oudere dieren of jonge dieren niet laten grazen in de meest gevaarlijke periode van het weideseizoen kunnen ervoor zorgen dat infectiedruk een stuk daalt. Ook de overlevingskansen van de zoetwater slak drastisch naar beneden brengen door een goede drainage van weiden met hoog waterpeil helpen al een stuk in het verminderen van pensbotinfecties.
Met de informatie over de invloed van het massaal verplaatsen van besmette dieren op de verspreiding van Calicophoron in UK en Ierland (uit de proef uitgevoerd onder leiding van universiteit van Edinburgh) is het voor de hand liggend dat het ook verstandig is om besmette dieren te behandelen. Kennis van de infectiestatus van nieuw aangekochte dieren is daarom ook zeker van belang.
Maar wat te doen met geïnfecteerde dieren?
In Europa zijn er momenteel géén anthelmintica geregistreerd voor de behandeling van pensbotinfecties.
In vele in vitro en in vivo studies werd gekeken naar de effectiviteit van verschillende ontwormingsmiddelen tegen pensbot. Er zijn geen algemeen geaccepteerde criteria vastgelegd om succesvolle behandeling met flukiciden te beoordelen bij de behandeling van trematodeninfecties. Daarom wordt zoals bij de behandeling van nematodeninfecties ook gekeken naar de vermindering van het aantal aanwezige eieren in de feces.
In een onderzoek in 2013 hebben Arias et al. gekeken naar de effectiviteit van albendazole, netobimin, closantel en oxyclozanide als behandeling van de pensbot Calicophoron daubneyi in natuurlijk geïnfecteerde koeien. Oxyclozanide en closantel, beide oraal toegediend, worden in deze studie als effectief bestempeld.
In de literatuur wordt oxyclozanide, geregistreerd voor de behandeling van leverbot, geadviseerd als “de” molecule ter behandeling van mature pensbot. De gebruikte dosering van oxyclozanide bij pensbotinfecties is hoger dan de geregistreerde dosering bij leverbotinfecties. Rolfe & Boray (1987) en Alzieu et al. (1999) onderzochten het effect van verschillende doseringen oxyclozanide op mature en immature pensbotten.
| Oxyclozanide |
Dosering (mg/kg) |
Aantal toedieningen |
% Effectiviteit op immature stadia |
% Effectiviteit op volwassen stadia |
|
|
10.2 mg/kg met stop dose |
1 |
– |
77.5 % |
Alzieu et al (1999) |
|
10.2 mg/kg zonder stop dose |
1 |
– |
94 % |
Alzieu et al (1999)
Mage et Reynal (1990) |
|
18.7 mg/kg |
2 x met 3 dagen interval |
– |
99.5 % |
Alzieu et al (1999) |
|
15 mg/kg |
1 |
85 % |
87,5–100 % |
Dorchies (2000) |
|
18,7 mg/kg |
1 |
61 – 96,1 % |
56,5–98,1 % |
Rolfe et Boray (1987) |
|
18,7 mg/kg |
2 x (3 dagen interval) |
99,90 % |
99,9–100 % |
Rolfe et Boray (1987) |
De hoge dosering van 18,7 mg/kg lichaamsgewicht tweemaal met drie dagen interval geeft een goede effectiviteit tegen zowel mature als immature stadia. Bij zulke hoge doseringen worden wel nevenreacties als diarree en lusteloosheid gemeld bij behandelde dieren. Deze verdwijnen 24-48 u na de behandeling. Uit angst voor de hierboven vermelde neveneffecten wordt er in het veld meestal gewerkt met een dosering van 10 mg/ kg lichaamsgewicht (zonder stop dose) tweemaal met drie dagen tussen en dit met goed resultaat.
Aangezien pensbotinfectie geen indicatie is van de oxyclozanide bevattende diergeneesmiddelen, kan de behandeling van paramphistomose met deze werkzame stof enkel gebeuren door toepassing van de cascade. Bij gebruik van hogere doseringen dan vermeld in de bijsluiter dient de dierenarts een wachttijd voor te schrijven die voldoende lang is om te garanderen dat de producten afkomstig van het dier geen ongewenste residuen bevatten.
Conclusie
Alhoewel een pensbotinfectie in de literatuur veelvuldig besproken wordt, zien we in het veld dat het voorkomen van pensbot wel wordt gediagnosticeerd maar dat een infectie met ernstige klinische verschijnselen bij koeien maar sporadisch voorkomt. Een recent onderzoek heeft aangetoond dat naast veranderende weersomstandigheden vooral de massale verplaatsing van positieve dieren de oorzaak is van de verhoogde prevalentie van de laatste jaren. Behandelen met een ontwormingsmiddel is alleen aan te raden wanneer daar op basis van het mestonderzoek aanleiding voor is. Onnodige behandelingen werken resistentie in de hand. Tot op heden is er nog geen product geregistreerd voor de behandeling van paramphistomum. Oxyclozanide is in de literatuur beschreven als effectief.
Referenties
- M. Huson et al., Paramphistomosis of ruminants: An emerging parasitic disease in Europe. Trends in parasitology, 2017, volume 33, No 11.
- Malrait et al., Novel insights into the pathogenic importance, diagnosis and treatment of the rumen fluke in cattle. Veterinary parasitology, 2015, pages 134–139.
- W. Ploeger et al., Presence and species identity of rumen fluke in cattle and sheep in the Netherlands. Veterinary pathology 243 (2017).
- Sargison et al., A high throughtput deep amplicon sequencing method to show the emergence and spread of Calicophoron daubneyi rumen fluke infection in United Kingdom cattle herds. Veterinary parasitology, 2019, pages 9-15.
- Kaufmann et al., Parasitic infections of domestic animals, A diagnostic manual. Birkhäuse verlag, Basel 423 pp.
- Hendrix et al., Diagnostic parasitology for veterinarian technicians. Mosby Elsevier, Missouri, 2006, p 107.
- Huson et al., Paramphistomum of ruminants: an emerging parasitic disease in Europe. Trends in Parasitology, 2017, Vol. 33, N˚
- Devos et al., Paramphistomosis in sheep. Revue de médecine vétérinaire, 2013 164 (11): 528-535.
- Bellet et al., Ostertagia spp., rumen fluke and liver fluke single and poly-infections in cattle: An abbatoir study of prevalence and production impacts in England and Wales. Preventive veterinary medicine, 2016, volume 132 pages 98-106.
- Chauvin, Trématodoses des ruminants. Le point vétérinaire, Parasitologie interne des ruminants, 2012, Vol 43, p 62-67.
- Ferreras et al., Calicophoron daubneyi in slaughtered cattle in Castilla y Léon. Veterinary Parasitology, 2014, Vol 199, p 268-271
- Knubben-Schweizer et al., Ein update zu pansenegeln in Deutshland, Hannover
- Fuertes et al., Pathological changes in cattle naturally infected by Calicophoron daubneyi adult flukes. Veterinary parasitology, 2015, volume 209 pages 188-196.
- Vercruysse, Parasitaire ziekten bij huisdieren. Deel I – Algemene inleiding. Cursus faculteit diergeneeskunde, 1992, page 10-13.
- Rieu et al., Reliability of coprological diagnosis of Paramphistomum spp. infections in cows. Veterinary parasitology, 2007, volume 146 pages 249-253.
- S. Arias et al., The efficacy of four anthelmintics against Calicophoron daubneyi in naturally infected cattle. Veterinary parasitology, 2013, volume 197 pages 126–129.
- Alzieu et al., Essai de traitement de la paramphistomose bovine par l’oxyclosanide. Rev.Méd.Vét., 1999, 150 (8-9), 715-718.
- Mage et al., Les paramphistomides; essai d’activité de quelques anthelminthiques. Bull. G.T.V., 1990, n˚4, 9-11.
- Dorchies et al., La paramphistomose bovine : une pathologie d’actualité. In : Comptes rendus du Congrès de la société française de buiatrie Paris, 15-17 novembre 2000, 132-142.
- Rolfe et al., Chemotherapy of paramphistomosis in cattle. Aust. Vet. J., 1987, 64, 328-332.