Doxycycline als oplossing bij varkens?
Eerste publicatie: 15 april 2020
Update: 9 april 2024
Gebruik van doxycycline
Doxycycline wordt relatief veel gebruikt voor de behandeling van respiratoire infecties bij varkens. Het is breed werkzaam, bekend in gebruik en normaal gesproken goed beschikbaar. Is het echter altijd de beste keuze en wat is bij beperkte beschikbaarheid het beste alternatief?
Beschikbaarheid van doxycycline
Op dit moment merken wij dat door beperkte productie in China, doxycycline moeilijker verkrijgbaar is dan normaal. Tegelijkertijd zien we door deze minder goede beschikbaarheid de prijs van de grondstof en het eindproduct stijgen. De afgelopen weken hebben we daarom regelmatig vragen ontvangen welke werkzame stoffen en producten als alternatief bij varkens gebruikt kunnen worden. In dit artikel hebben wij een overzicht gemaakt van de producten die als alternatief kunnen dienen voor de behandeling van bacteriële luchtweginfecties bij varkens.
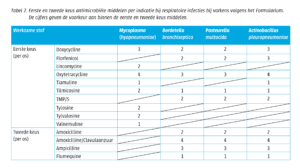
Assortiment van Dopharma
De belangrijkste infecties die (conform SPC) met Doxylin® 100% behandeld kunnen worden zijn infecties met Pasteurella multocida, Bordetella bronchiseptica en Actinobacillus pleuropneumoniae. Tetracycylines zijn in het algemeen ook werkzaam tegen Mycoplasmata. In de SPC van Doxylin 100% wordt M. hyorhinis vernoemd. Hieronder ziet u een selectie van de bij Dopharma beschikbare producten voor drinkwatermedicatie die bij respiratoire infecties bij varkens gebruikt mogen worden.
Belangrijke eigenschappen per product
Oxytetracycline HCl is een wateroplosbaar poeder en bevat 100% oxytetracyclinehydrochloride. Oxytetracycline behoort net als doxycycline tot de tetracyclines. Het werkingsspectrum en –mechanisme zijn dan ook vergelijkbaar. De farmacokinetische eigenschappen van oxytetracycline zijn echter minder gunstig dan die van doxycycline wat betreft respiratoire infecties: door de lagere vetoplosbaarheid van oxytetracycline wordt er een minder hoge concentratie in longweefsel bereikt.
De beschikbaarheid van oxytetracycline is op dit moment net als doxycycline beperkt en lijkt daarom geen goed alternatief voor doxycycline.
Amoxy Active® 697 mg/g is een wateroplosbaar poeder dat 80% amoxicilline trihydraat bevat (dit komt overeen met 69,7% amoxicilline). Amoxicilline is een aminopenicilline en interfereert met de bacteriële celwandsynthese. Hierdoor heeft het een bactericide werking. Amoxy Active 697 mg/g is o.a. geïndiceerd voor de behandeling van luchtweginfecties door gevoelige micro-organismen. Omdat penicillines de celwand als target hebben zijn ze echter niet werkzaam tegen Mycoplasmata. Ook de behandeling van Bordetella bronchiseptica infecties is meestal niet effectief omdat Bordetella’s vaak lactamasen produceren die penicllines enzymatisch afbreken. Amoxicilline werkt dus minder breed dan de tetracyclines. Belangrijk is ook dat amoxicilline in Nederland een tweede keus middel is.
T.S.-Sol® (20/80) is een orale oplossing en bevat opgeteld 10% trimethoprim en sulfamethoxazol. Het product T.S.-Sol® 20/100 bevat 12% van dezelfde werkzame stoffen. Trimethoprim en sulfonamiden werken synergistisch en remmen de bacteriële DNA-synthese. De combinatie van werkzame stoffen heeft een bactericide activiteit. De goede oplosbaarheid van deze producten is niet voor de hand liggend omdat beide werkzame stoffen slecht oplosbaar zijn en ook nog bij verschillende pH’s hun optimale oplosbaarheid in water vertonen. Vanwege de specifieke formulering worden beide Dopharma-producten echter al jarenlang succesvol ingezet als drinkwatermedicatie. Over het algemeen zijn deze producten zeer effectief voor de behandeling van pleuropneumonie.
Tylogran® 1000 mg/g is ook een wateroplosbaar poeder en bevat 100% tylosine tartraat. Tylosine behoort tot de macroliden en remt ook de eiwitsynthese. De opname vanuit de darm en de verspreiding naar de weefsels is goed. Het werkingsspectrum (vooral Gram positief en Mycoplasmata) en de geregistreerde luchtwegindicaties zijn smal vergeleken met doxycycline.
Tilmicosine als goed alternatief voor doxycycline
Tildosin® 250 mg/ml is een orale oplossing. Dit product bevat 25% tilmicosine en deze werkzame stof behoort ook tot de macroliden. Tilmicosine wordt na orale toediening goed opgenomen en verspreidt zich snel naar weefsels met een lage pH. Zes uur na de start van de behandeling worden er al tilmicosine concentraties in de longen gevonden. Het is bekend dat tilmicosine zich concentreert in alveolaire macrofagen van het varken1. Behalve een goede oplosbaarheid en goede farmacokinetische eigenschappen voor de behandeling van luchtweginfecties heeft tilmicosine nog enkele bijzondere voordelen:
- In de alveolaire macrofagen wordt de vermeerdering van PRRS-virus geremd2,3.
- Tilmicosine heeft anti-inflammatoire eigenschappen waardoor de heftige ontstekingsreactie, die bij bacteriële luchtweginfecties vaak ontstaat, wordt verminderd4.
- Tilmicosine heeft een belangrijk Post Antibiotisch Effect (PAE): na het stoppen van de behandeling blijft er gedurende twee dagen een effectieve concentratie aanwezig in serum en longen5.
Al met al bevat Tildosin® 250 mg/ml een interessant molecuul voor de behandeling van bacteriële luchtweginfecties bij het varken. Het is hiermee een zeer geschikt alternatief voor de behandeling met doxycycline. Ook in het Formularium6 van de WVAB heeft tilmicosine vaak de voorkeur boven andere eerste keus middelen.
Discussie
Is doxycycline de beste keuze voor de behandeling van luchtweginfecties bij varkens? Ondanks dat doxycycline zeer waardevol is als diergeneesmiddel in de tool-box van de dierenarts is het antwoord nee. Ook tilmicosine, wat een zeer goed alternatief is voor doxycycline, is niet bij voorbaat de beste keuze voor elke behandeling. Het is Good Veterinary Practice om iedere casus apart te bekijken en te handelen naargelang de bedrijfsspecifieke omstandigheden.
Prudent use van antibiotica betekent zowel een verantwoord gebruik als het rationeel gebruik van deze diergeneesmiddelen. Onder verantwoord gebruik verstaan we de inzet van antibiotica alleen als het echt nodig is. Alle omstandigheden die een invloed op infecties hebben moeten geoptimaliseerd worden. Denk hierbij aan voeding, huisvesting, management, biosecurity maar ook aan het preventief gebruik van vaccins en supplementen op risicomomenten. Rationele toepassing van antibiotica betekent de inzet van de meest geschikte werkzame stof of zelfs het meest geschikte product voor elke casus. Het begint hierbij met een juiste diagnose. Doordat er het afgelopen decennium veel aandacht is geweest voor verantwoord antibioticumgebruik, heeft de sector een enorme reductie kunnen bewerkstelligen. Dit heeft tot gevolg gehad dat veel bedrijven “schoner” zijn geworden en dat mono-infecties van bacteriën meer voorkomen dan vroeger. Hierdoor is niet altijd een breed werkzaam antibioticum automatisch de beste keuze. Met behulp van een juiste diagnose, kennis van farmacodynamiek & farmacokinetiek en kennis van de antibioticagevoeligheid van te bestrijden bacteriën kan zo het diergeneesmiddel gekozen worden waarvan de beste effectiviteit verwacht kan worden. Dit helpt in verdere reductie van antibioticagebruik en kan zelfs het risico op resistentieontwikkeling verminderen. Ook de praktische toepasbaarheid van een product is een belangrijke overweging: oplosbaarheid, stabiliteit en specifieke toepassing (bijvoorbeeld continue dosering of puls-dosering) zijn bij drinkwatermedicatie zeer belangrijk. De bedrijfsspecifieke omstandigheden kunnen tenslotte mede bepalen of een bepaald product of een bepaalde toedieningsweg geschikt is voor het bedrijf.
Dopharma is er zich van bewust dat u als dierenarts een brede keuze moet hebben om antibiotica rationeel voor te kunnen schrijven. In het huidige klimaat van druk op antibiotica en steeds strengere productie-eisen, is het echter niet vanzelfsprekend om als veterinair farmaceutisch producent een breed assortiment in stand te houden of het antimicrobiële assortiment zelfs uit te breiden. U kunt er echter op rekenen dat wij als marktleider op dit gebied ons meer dan 100% inzetten om dit toch te bewerkstelligen.
Indien u advies wilt over de inzet van het meest geschikte antibioticum voor uw casus kunt u uiteraard contact opnemen met de specialisten van Dopharma.
Referenties (naast de SPC’s van de besproken producten)
1. Scorneaux B & Shryock TR. Intracellular accumulation, subcellular distribution and efflux of tilmicosin in swine phagocytes. J. vet. Pharmacol. Therap. 1998;21:257-268
2. Du Y et al. Antiviral activity of tilmicosin for type 1 and type 2 porcine reproductive and respiratory syndrome virus in cultured porcine alveolar macrophages. J Antivir Antiretrovir. 2011;3(3):28-33
3. Lin C-N et al. Tilmicosin reduces PRRSV loads in pigs in vivo. J Agricult Sci. 2016; 8(1):154-162
4. Paradis MA et al. PulmotilTM in piglets infected with Actinobacillus pleuropneumoniae: effects on apoptosis, leukotriene B4, and inflammation of the lung. Proceedings of the 18th IPVS; 2004 jun 27-jul 1; Hamburg, Germany
5. Karankolova M et al. Efficacy of an alternative Tilmovet® treatment scheme in pigs. Proceedings of the 23th IPVS; 2014 Jun 8-11; Cancun, Mexico
6. Van Duijkeren et al. Formularium varken. Houten: WVAB van de KNMvD; 2019. Beschikbaar via: https://www.knmvd.nl/app/uploads/sites/4/2019/09/formularium-varken_230919.pdf