Wormen spelen een belangrijke rol bij commercieel gehouden pluimvee. In dit artikel worden de verschillende wormen en hun eigenschappen besproken en wordt het gebruik van flubendazole toegelicht.
Worminfecties bij pluimvee
Worminfecties zijn belangrijk en ongewenst, omdat ze klinische verschijnselen en een negatief effect op de productie kunnen veroorzaken. Daarnaast kunnen ze ook een rol kunnen spelen bij de overdracht van bijv. Histomonas spp. de kans op andere infecties, zoals met E.coli of Pasteurella spp. Tot slot kan een Ascaridia galli infectie interfereren met de ontwikkeling van immuniteit na een NCD vaccinatie.
Problemen door wormen worden vooral waargenomen bij leghennen en ouderdieren. Vleeskuikens worden vaak al vóór het einde van de prepatentperiode geslacht (de periode tussen infectie van de gastheer en de uitscheiding van wormeieren door de gastheer).
Sinds het verbod op kooihuisvesting worden steeds meer dieren gehouden in scharrelsystemen. Bij deze manier van huisvesting komen de dieren in veel grotere mate in contact met mest, en worden ze dus ook meer blootgesteld aan wormeieren. Hierdoor neemt de infectiedruk toe.
Daarnaast hebben steeds meer kippen de beschikking over een uitloop. Met regelmaat wordt beschreven dat deze dieren ernstigere worminfecties hebben dan dieren die binnen worden gehuisvest. Dit kan verklaard worden door het onvermogen om wormeieren goed uit de uitloop te verwijderen en door de blootstelling aan tussengastheren in de uitloop. Dat de prevalentie van worminfecties hoog is in de biologische veehouderij blijkt uit een Europese studie waarin 55 biologische leghennenbedrijven zijn onderzocht. De prevalentie van A.galli, Heterakis spp. en Raillietina spp. waren respectievelijk 69,5%, 29,0% en 13,6% voor Europa. In deze studie zijn twee Nederlandse bedrijven onderzocht waar de prevalenties respectievelijk 96,7%, 100% en 33,3% waren. In dezelfde studie werd echter ook geconcludeerd dat er een negatieve correlatie was tussen de tijd dat de dieren in de uitloop doorbrachten en de besmettingsdruk met A.galli. Dit zou volgens de auteurs mogelijk verklaard worden omdat de blootstelling aan bijvoorbeeld zonlicht een negatieve invloed kan hebben op de overleving van wormeieren.

Nematoden
Nematoden zijn rondwormen. De volwassen wormen hechten zich meestal niet aan de mucosa, maar irriteren deze alleen. Haarwormen zijn hierop een uitzondering, omdat deze zich wel vasthechten. Larven hechten vaak wel aan de darmwand of penetreren deze zelfs tijdens hun ontwikkeling.
Nematoden hebben een directe ontwikkelingscyclus. De eieren die uitgescheiden worden zijn niet infectieus. De tijd tussen de uitscheiding en het infectieus worden van de eieren (rijping) wordt weergegeven in onderstaande tabellen. De exacte periode is afhankelijk van de omstandigheden; een vochtige en warme omgeving zorgt voor een snelle ontwikkeling.
Grote spoelwormen
| Naam |
Ascaridia galli |
| Omvang wormeieren (µm) |
L: 73 – 92
B: 45 – 57 |
| Lengte worm (mm) |
50 – 76 (m)
60 – 116 (v) |
| PPP1 (dagen) |
28 – 35 |
| Rijping2 (dagen) |
10 – 20 |
| Predilictieplaats |
Dunne darm |
| Verschijnselen |
Gewichtsverlies, productiedaling, daling eischaalkwaliteit, diarree en anemie. |
| Pathologie |
Enteritis |
| Potentiële overdracht van |
Salmonella spp.
Reovirus |
1 PPP = prepatentperiode = de periode tussen infectie van de gastheer en de uitscheiding van wormeieren door de gastheer.
2 Rijping = periode tussen uitscheiding van de eieren en infectieus worden van de eieren.
De grote spoelworm komt vooral voor in de dunne darm, maar kan ook gevonden worden in de oesophagus, krop, spiermaag, oviduct en het ei.
Spoelwormen produceren enorm veel eieren en de infectieuze eieren blijven maandenlang in het strooisel aanwezig. Hoewel er geen tussengastheer nodig is voor de ontwikkeling van spoelwormen, kunnen slakken, kevers en regenwormen deze parasieten wel overdragen. De larven van de grote spoelworm penetreren de darmwand voor hun ontwikkeling van L2 naar L3.
Bij kippen worden vooral volwassen wormen gevonden. Bij kalkoenen is de infectiedruk vaak hoger dan bij kippen en worden gedurende het gehele leven L3 stadia gevonden.
Kleine spoelwormen
| Naam |
Heterakis gallinarum |
| Omvang wormeieren (µm) |
L: 63 – 75
B: 36 – 50 |
| Lengte worm (mm) |
7 – 13 (m)
10 – 15 (v) |
| PPP1 (dagen) |
21 – 30 |
| Rijping2 (dagen) |
14 |
| Predilictieplaats |
Caecum |
| Verschijnselen |
Er treden zelden klinische verschijnselen op. |
| Pathologie |
Verdikking darmwand (vooral caeca), knobbeltjes in mucosa en submucosa, granulomen in de lever |
| Potentiële overdracht van |
Histomonas spp. (Blackhead) |
1 PPP = prepatentperiode = de periode tussen infectie van de gastheer en de uitscheiding van wormeieren door de gastheer.
2 Rijping = periode tussen uitscheiding van de eieren en infectieus worden van de eieren.
De larven van de kleine spoelworm penetreren de darmwand niet, maar ze zullen zich gedurende de eerste 12 dagen van een infectie wel aan de mucosa hechten.
De kleine spoelworm kan een tussengastheer zijn voor Histomonas spp. Wormeieren die besmet worden met Histomonas spp kunnen gedurende een jaar besmet blijven. Bij kalkoenen is dit het belangrijkste gevolg van een infectie met de kleine spoelworm; klinische verschijnselen ten gevolge van de worminfectie zelf worden bij deze diersoort nauwelijks gezien.
Haarwormen
| Naam |
Capillaria obsignata |
Capillaira caudinflata |
| Omvang wormeieren (µm) |
L: 44 – 46
B: 22 – 29 |
L: 47 – 58
B: 20 – 24 |
| Lengte worm (mm) |
7 – 13 (m)
10 – 18 (v) |
9 – 18 (m)
12 – 25 (v) |
| PPP1 (dagen) |
21 – 28 |
|
| Rijping2 (dagen) |
9 – 14 (direct)
14 – 21 (indirect) |
|
| Predilictieplaats |
Dunne darm & caeca |
| Verschijnselen |
Bloederige diarree, anemie, gewichtsverlies, legdaling en daling van het uitkomstpercentage. |
| Pathologie |
Ontsteking en verdikking krop en oesophagus en enteritis. |
1 PPP = prepatentperiode = de periode tussen infectie van de gastheer en de uitscheiding van wormeieren door de gastheer.
2 Rijping = periode tussen uitscheiding van de eieren en infectieus worden van de eieren.
Haarwormen kunnen ernstige darmschade veroorzaken, omdat ze zich vasthechten aan het darmslijmvlies. Deze wormen kunnen in de hele darm voorkomen, maar beschadigingen worden vooral gezien in de dunne darm en caeca.
Na de uitscheiding van de wormeieren moeten ze rijpen om infectieus te worden. Dit gaat vrij snel waardoor de infectiedruk snel kan toenemen. Dit is de reden dat bij een infectie met deze wormen geadviseerd wordt om ook bij een lage EPG te behandelen of de dieren in ieder geval goed in de gaten te houden. De wormeitjes van haarwormen blijven minder lang infectieus dan de eieren van spoelwormen.
Gaapwormen
| Naam |
Synagmus trachea |
| Omvang wormeieren (µm) |
L: 90
B: 49 |
| Lengte worm (mm) |
2 – 6 (m)
5 – 20 (v) |
| PPP1 (dagen) |
16 – 20 |
| Rijping2 (dagen) |
8 – 14 |
| Predilictieplaats |
Trachea |
| Verschijnselen |
Benauwdheid |
| Pathologie |
Ontsteking trachea met verdikking waar de mannelijke wormen aanhechten aan de mucosa. |
| Transportgastheren |
Slakken, regenwormen, kevers. |
1 PPP = prepatentperiode = de periode tussen infectie van de gastheer en de uitscheiding van wormeieren door de gastheer.
2 Rijping = periode tussen uitscheiding van de eieren en infectieus worden van de eieren.
Gaapwormen zijn in tegenstelling tot de voorgaande wormen geen maagdarmwormen. Ze veroorzaken infecties van de trachea. Verschijnselen zoals benauwdheid worden vooral gezien bij jonge dieren, omdat de trachea hier relatief snel verstopt raakt door de wormen.
De cyclus verloopt wel via het maagdarmkanaal. De wormeieren worden opgehoest, doorgeslikt en uitgescheiden via de ontlasting. Een dier kan geïnfecteerd raken met deze worm door opname van het ei, de larve (L3) of een transportgastheer. De larven verplaatsen zich vervolgens via de bloedsomloop naar de luchtwegen.
De wormeitjes kunnen in de omgeving lang infectieus blijven. Er zijn zelfs rapporten bekend van larvale stadia die in de regenworm gedurende 4 jaar infectieus bleven. De wormen zijn te herkennen door de Y-vorm, die ontstaat omdat de mannelijke en vrouwelijke worm permanent in copulatie leven.
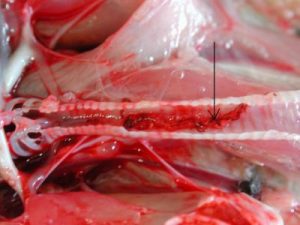
Cestoden
Lintwormen (cestoden) vallen onder de platwormen. De eitjes worden niet individueel uitgescheiden, maar als proglottiden. Dit zijn segmenten van de worm die gevuld met eitjes afgestoten worden. Deze zijn lastig te onderscheiden in de faeces, vooral als ze ingedroogd zijn.
De ontwikkeling van lintwormen is afhankelijk van tussengastheren zoals kevers, vliegen en mieren en we spreken hier dus van een indirecte cyclus. De tussengastheren nemen de proglottiden op. Vervolgens komt de larve in het maagdarmkanaal van de tussengastheer uit het ei. Deze larve ontwikkelt zich tot cystercoid en blijft in de lichaamsholte van de tussengastheer totdat deze opgenomen wordt door de eindgastheer.
Lintwormen
| Naam |
Raillietina spp. (grote lintworm) |
| Omvang wormeieren (µm) |
L: 94
B: 74 |
| Lengte worm (mm) |
15 – 38 |
| PPP1 (dagen) |
14 – 21 |
| Predilictieplaats |
Dunne darm |
| Verschijnselen |
Zwakte, vermagering en legdaling. |
| Pathologie |
Enteritis met hyperplasie |
| Transportgastheren |
Kevers (o.a. tempexkever)
Vliegen
Mieren |
| Potentiële overdracht van |
Adenovirus
Reovirus |
1 PPP = prepatentperiode = de periode tussen infectie van de gastheer en de uitscheiding van wormeieren door de gastheer.
2 Rijping = periode tussen uitscheiding van de eieren en infectieus worden van de eieren.
Deze wormen hechten zich met de kop vast aan de darmmucosa. Hierdoor kunnen ze schade aan de darm veroorzaken en zijn ze dus vrij pathogeen.
Omdat lintwormen een indirecte cyclus hebben is het in dit geval belangrijk niet alleen de worminfectie zelf te behandelen, maar ook maatregelen te nemen waarmee de tussengastheren, zoals de tempexkever, bestreden worden.
Anthelminthica
Benzimidazolen
De enige geregistreerde diergeneesmiddelen voor de behandeling van worminfecties bij kippen behoren tot de groep van de benzimidazolen. Benzimidazolen bestaan uit een imidazole ring gebonden aan een benzeen ring. Het werkingsmechanisme is gebaseerd op hun binding aan β-tubulines. Hierdoor wordt voorkomen dat microtubuli gevormd worden, welke belangrijk zijn voor het transport van nutriënten zoals glucose. Dit leidt tot een tekort aan ATP in de wormen en heeft als zodanig een biocide effect.
Benzimidazolen lossen slecht op in water. Dit zorgt voor een beperkte biologische beschikbaarheid. Na absorptie is het verdelingsvolume wel groot en wordt onder andere ook het centrale zenuwstelsel bereikt. Dit wordt verklaard door de goede vetoplosbaarheid. De plasma-eiwitbinding is ongeveer 50%. Benzimidazolen worden na conjugatie via de gal uitgescheiden.
Deze anthelmintica hebben een ruime veiligheidsindex en de kans op bijwerkingen is dus zelfs bij overdoseringen gering. Het is echter wel bekend dat het gebruik van fenbendazol bij duiven tijdens de rui veerbeschadigingen kan geven.
Flubendazol is niet alleen werkzaam tegen larven en volwassen nematoden en lintwormen, maar ook tegen nematodeneieren. In een recente studie is aangetoond dat flubendazole bij pluimvee werkzaam is tegen alle inwendige stadia van Ascaris galli (eieren, larven en volwassen wormen).
In deze studie van Tarbiat et al werd echter ook aangetoond dat de grote spoelworm na het ontwormen alweer snel terug gevonden kan worden in de mest; de larven kunnen na één week al weer gevonden worden, terwijl de volwassen stadia al na vier weken weer aanwezig kunnen zijn. Dit is een indicatie dat de prepatentperiode dus mogelijk aangepast moet worden naar vier weken, en roept de vraag op of het ook niet verstandig zou zijn het interval van ontwormen hierop aan te passen.
Wormen kunnen resistent worden tegen benzimidazolen. De resistentiefactor ligt waarschijnlijk op één gen en zorgt voor een modificatie van de β-tubulines. In de studie van Tarbiat et al (2016) werd echter geconcludeerd dat er nog geen tekenen van resistentie waren.
Strategisch ontwormen
De meeste pluimveehouders kiezen voor strategische ontworming. Hierbij worden de kippen met vaste intervallen ontwormd. Het standaard interval van ontwormen is zes weken. Uitzondering hierop is tijdens de opfok of bij een hoge infectiedruk. Hier wordt vaak iedere vijf weken ontwormd. Ontworming van kippen aan het eind van de opfokperiode zorgt ervoor dat ze ‘schoon’ naar het legbedrijf gaan.
Bovenstaand schema is gebaseerd op de prepatentperiode van de grote spoelworm. Recent onderzoek heeft echter aangetoond dat de cyclus van de grote spoelworm in leghennen ook in vier á vijf weken doorlopen kan worden. Zelfs na een effectieve ontworming worden er na ongeveer zeven dagen al larvale stadia aangetoond. Volwassen stadia en wormeieren kunnen al vanaf 28 dagen na ontworming worden gevonden. Het standaard ontwormschema van zes weken zou op basis hiervan mogelijk aangepast moeten worden.
Wanneer de wormbesmetting in een koppel veroorzaakt wordt door andere wormsoorten moet het ontwormschema hierop aangepast worden. Een effectieve ontworming betekent ontwormen binnen de prepatentperiode. Op deze manier wordt voorkomen dat er grote hoeveelheden wormeieren worden uitgescheden en dat de infectiedruk weer oploopt.
De geadviseerde intervallen zijn als volgt:
- Grote spoelwormen: 4-5 weken
- Kleine spoelwormen: 4 weken
- Haarwormen, gaapwormen of lintwormen: 3 weken
Daarnaast kan men de mate van infectiedruk ook meenemen bij het opstellen van een ontwormschema. Klinische verschijnselen en productiedaling treden vaak alleen op bij massale infecties. Bij een lage infectiedruk is soms een tweede cyclus nodig voordat deze mate van infectie wordt bereikt. Behandeling is bij een lichte infectiedruk dan ook niet altijd nodig.
Ontwormen op basis van mestmonsters of sectie
Zoals hierboven al duidelijk is geworden, is het ideale ontwormschema afhankelijk van meerdere factoren. Mestonderzoek waarbij gekeken wordt naar het aantal wormeieren kan gebruikt worden om te bepalen wat het optimale ontwormschema op een specifiek bedrijf is. Hiervoor wordt het aantal eieren per gram faeces geteld (EPG – eggs per gram). Het is mogelijk om wormeieren te differentiëren na flotatie. De meeste wormeieren zijn goed van elkaar te onderscheiden. Alleen het onderscheid tussen de grote en kleine spoelwormeieren is moeilijk te maken; beide wordt vaak ingedeeld als Ascaris eieren. Standaard wordt het mestonderzoek iedere 6 weken uitgevoerd. Problemen in de koppel of een ziektegeschiedenis met wormproblemen kunnen echter aanleiding zijn vaker onderzoek uit te voeren.
Het is echter wel belangrijk om te realiseren dat het bepalen van een EPG niets zegt over de aanwezigheid van onvolwassen wormen, zoals die gevonden worden tijdens de prepatentperiode. Tijdens deze periode kunnen enorme hoeveelheden wormen in ontwikkeling zijn, maar is een EPG negatief.
Het behandeladvies is afhankelijk van de wormsoort die de infectie veroorzaakt en de gevonden EPG. Een overzicht wordt gegeven in de tabel hieronder.
| Wormen |
EPG |
Behandeladvies |
| Spoelwormen |
0 > EPG < 50 |
Afwachten tot volgend mestonderzoek |
| 50 < EPG < 300 |
Direct behandelen
Mestonderzoek na de behandeling |
| EPG > 300 |
Direct behandelen
Behandeling herhalen na 4 weken |
| Haarwormen |
0 > EPG < 50 |
Afwachten tot volgend mestonderzoek |
| EPG > 50 |
Direct behandelen
Behandeling herhalen na 3 weken |
| Lintwormen |
EPG > 0 |
Direct behandelen
Behandeling herhalen na 2 weken |
Bij een lage EPG wordt vaak geadviseerd te wachten met behandelen tot na een volgend mestonderzoek. Het is echter wel belangrijk gedurende deze periode extra alert te zijn op mogelijke verschijnselen van worminfecties.
Naast mestonderzoek kan natuurlijk ook sectie een rol spelen bij het vaststellen van worminfecties. Het is echter wel belangrijk dat als er secties worden gedaan om de wormbelasting te bepalen, dit niet bij de zwakke dieren uit het koppel wordt gedaan. Deze dieren vertonen vaak ernstigere besmettingen en laesies dan de betere dieren waardoor een vertekend beeld kan ontstaan.
Referenties
- Afdeling-Duurzame-Landbouw-Ontwikkeling. (2011). Impact van worminfecties op de algemene gezondheidsstatus van leghennen in niet-kooisystemen: resultaten van ADLO demonstratieproject. Diergezondheidszorg Vlaanderen vzq.
- Berx, C., Helsen, L., Röttger, R., Wellens, M., Helsen, K., Verhaert, I.,Toelen, D. (2011). Wormbesmettingen bij leghennen in niet-kooihuisvesting – Resultaten van een demonstratieproject in de leghennenhouderij.
- Degudab, (2015). Advies Ontworming Moederdieren.
- Fidin, QP52A Anthelmintica tegen trematoden, nematoden en cestoden.
- Fidin, QP52C Anthelmintica tegen nematoden (rondwormen, spoelwormen).
- McDougald, L.R. (2008). Cestodes and nematodes. In Y.M. Saif (Ed.), Diseases of Poultry (Vol. 12th edition, pp. 1057-1066). Iowa, United States: Blackwell publishing.
- Reuvekamp, N., Mul, M., & Fiks-van Niekerk, T. (2008). Literatuurstudie naar wormen bij legpluimvee.
- Tarbiat, B., Jansson, D.S., Moreno, L., Lanusse, C., Nyland, M., Tydén, E., Höglund, J. (2016) The efficacy of flubendazole against different developmental stages of the poultry roundworm Ascaridia galli in laying hens. Veterinary Parasitology 218: 66-72.
- Thapa, S., Hinrichsen, L. K., Brenninkmeyer, C., Gunnarsson, S., Heerkens, J. L., Verwer, C., . . . Mejer, H. (2015). Prevalence and magnitude of helminth infections in organic laying hens (Gallus gallus domesticus) across Europe. Vet Parasitol, 214(1-2), 118-124. doi:10.1016/j.vetpar.2015.10.009.
- Tomza-Marciniak, A., Pilarczyk, B., Tobianska, B., & Tarasewicz, N. (2014). Gastrointestinal parasites of free-range chickens. Ann Parasitol, 60(4), 305-308.
- Van Meirhaeghe, H. (2010). Wormen bij leghennen in alternatieve huisvesting. Diergezondheidszorg Vlaanderen vzw.
- Wagenaar, J.P., & Bestman, M. (2005). Parasitaire wormen bij biologische leghennen – Onderzoek naar het voorkomen van maagdarmwormen op 13 biologische leghenbedrijven.
- Yazwinski, T.A., & Tucker, C.A. (2008). Nematodes and Acanthocephalans. In Y.M. Saif (Ed.), Diseases of Poultry (Vol. 12th edition, pp. 1025-1056). Iowa, United States: Blackwell publishing.