Trueperella pyogenes, een wolf in schaapskleren
Al ruim twee jaar biedt Dopharma in samenwerking met Ripac diagnostiek en bedrijfsspecifieke vaccins voor herkauwers aan.
Een correcte diagnose ligt aan de basis van een effectief bedrijfsspecifiek vaccin. Hiervoor is een goede monstername van belang. Monsters genomen uit de plaats van infecties hebben uiteraard de voorkeur. Door middel van bacteriologisch onderzoek wordt er gezocht naar de primaire pathogenen. Het is niet altijd evident om deze primaire veroorzakers te identificeren en te kweken.
Een kiem die regelmatig uit verschillende purulente en necrotiserende letsels wordt geïsoleerd is Trueperella pyogenes. Maar hoe moeten we de aanwezigheid van deze kiem interpreteren? Wat weten we over deze bacterie?
Trueperella pyogenes
Zegt de naam Trueperella pyogenes u niets? Dat zou kunnen. Deze bacterie is dan ook al drager geweest van de volgende namen: Bacillus pyogenes, Corynebacterium pyogenes, Actinomyces pyogenes, Arcanobacterium pyogenes en uiteindelijk nu Trueperella pyogenes.
Taxonomie
De naam van een bacterie wordt gevormd door de naam van het genus (geslacht) waar de bacterie toe behoort, gevolgd door de naam van het species. De naam van bestaande bacteriën kan in de tijd ook weleens te veranderen. De laatste naamsverandering en daarbij ook een reclassificering van het geslacht Arcanobacterium is gebeurd naar aanleiding van het resultaat van een onderzoek waarin de chemotaxonomische kenmerken en de fylogenetische posities van de leden van het geslacht Arcanobacterium vergeleken werden. Dit resultaat bracht aan het licht dat het geslacht Arcanobacterium niet monofyletisch is, maar dat het geslacht uit twee verschillende lijnen bestaat nl. een groep bestaande uit o.a. Arcanobacterium haemolyticum en anderzijds een nieuwe robuuste groep bestaande uit de soorten zoals o.a. Arcanobacterium pyogenes. Door deze bevinding werd aan de leden van de nieuwe groep de naam Trueperella gegeven.
Bacterie
Voorkomen
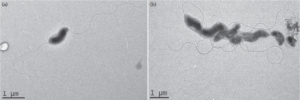
Trueperella pyogenes is een klein (0.2 – 0.3 x 0.5 – 2 µm) pleomorf Gram-positief staafje. De kiem is obligaat parasitair, facultatief anaeroob, ook facultatief pathogeen en niet sporevormend.
Trueperella is een omgevingskiem die bij veel dieren tot de gewone flora van de huid en slijmvliezen behoort. Deze bacterie maakt ook deel uit van de gastro-intestinale microbiota bij runderen en varkens en kan ook gevonden worden op de uier van klinisch gezonde koeien. T. pyogenes is echter ook een belangrijke opportunistische ziekteverwekker wanneer hij de kans krijgt om beschadigd weefsel binnen te dringen. Dit verklaart waarom Trueperella pyogenes dikwijls geïsoleerd wordt uit allerhande purulente ziekteprocessen.
Virulentiefactoren
De virulentie van T. pyogenes wordt toegeschreven aan verschillende mechanismen:
- Virulentiefactoren verantwoordelijk voor de aanhechting en kolonisatie van de slijmvliezen:
- Pyolisin
Dit is een krachtig cholesterolafhankelijk cytotoxine. Het pyolisin bindt aan cholesterol bevattende celmembranen waardoor poriën gevormd worden welke cytolyse veroorzaken. Het toxine induceert hemolyse, verandering van cytokine-expressie van de gastheer en cytolyse van verschillende cellen waaronder de immuuncellen (PMN en macrophagen) en endometriumcellen. Bij koeien is de weefselschade veroorzaakt door T. pyogenes van grote invloed op de gezondheid van het endometrium en bijgevolg ook op de fertiliteit. Pyolisin wordt gezien als de belangrijkste virulentiefactor van T. pyogenes. - Neuraminidase
Neuraminidasen (nanH en nanP genen) zijn belangrijke factoren bij het bevorderen van de aanhechting aan het epitheel van de gastheer. Daarnaast spelen deze een belangrijke rol in het verminderen van viscositeit van de slijmvliezen waardoor bacteriën onderliggende weefsels beter kunnen koloniseren. Ook zijn ze verantwoordelijk voor een verhoogde gevoeligheid van IgA voor bacteriële proteases. - Collageen bindend eiwit
Het collageen bindend eiwit (CbpA) zorgt voor aanhechting aan collageenrijk weefsel en komt voor bij 48% van de T. pyogenes isolaten. - Fimbriae
Fimbriae (fimA, fimB, srtA genen) zijn betrokken bij de aanhechting aan de gastheercellen.
- Pyolisin
- Ontwikkeling van pyogranulomateuze reacties in weefsels en organen.
- Capaciteit tot het vormen van een biofilm.
- Aanwezigheid van bepaalde resistentiegenen waaronder:
- tetW – tetracycline resistentiegen;
- ermB en ermW – macroliden resistentiegenen;
- aacC, aadA1 en aadA2 – aminoglycosiden resistentiegenen;
- blaP1 – β-lactam resistentiegen;
- orfE – aanvullende antibioticum resistentiegenen met onbepaalde functie.
Al deze mechanismen zijn verantwoordelijk voor de schade die Trueperella pyogenes kan veroorzaken bij de gastheer.
In het veld worden over het algemeen geen verschillen gevonden tussen de genotypes van commensale en klinische T. pyogenes isolaten. In sommige onderzoeken werd echter wel gezien dat de virulentiefactor Fim A meer voorkomt bij de T. pyogenes die verantwoordelijk is voor klinische gevallen.
Bij de nutsdieren komen infecties met Trueperella vooral voor bij runderen, varkens, schapen, geiten, eenden en heel af en toe bij paarden. In dit artikel zullen we ons echter beperken tot de verschillende aandoeningen die bij het rund voorkomen.
Trueperella pyogenes bij het rund
Bij runderen kan T. pyogenes als primaire pathogeen een infectie veroorzaken. Echter, in het merendeel van de gevallen is Trueperella medeveroorzaker van polybacteriële ziekten als uteriene infecties, abortus, mastitis, pneumonie, interdigitale necrobacillose, orale necrobacillose en abcessen.
Het valt op dat bij polybacteriële aandoeningen, Trueperella pyogenes als facultatief anaerobe bacterie dikwijls gevonden wordt samen met andere Gram-negatieve anaerobe bacteriën zoals Fusobacterium necrophorum, Peptostreptococcus indolicus en Prevotella melaninogenica. Met sommige van deze bacteriën leeft T. pyogenes in synergie. Een voorbeeld hiervan is de onderlinge synergistische samenwerking tussen Trueperella pyogenes en Fusobacterium necrophorum. T. pyogenes vermindert de zuurstofdruk en het oxidatie-reductiepotentieel op de plaats van infectie waardoor optimale anaerobe condities worden gecreëerd voor de groei van Fusobacterium necrophorum. Daartegenover zorgt een leukotoxine geproduceerd door F. necrophorum, met zijn vermogen om leucocyten af te doden, dat T. pyogenes beschermd wordt tegen fagocytose. Bovendien kan melkzuur, dat een metaboliet is van T. pyogenes, gebruikt worden als energiebron door F. necrophorum. De exotoxines van beide kiemen veroorzaken behoorlijke necrose van de weefsels en beschadiging van de vaatwand. Vanuit het oorspronkelijk aangetaste weefsel kunnen dan uitzaaiingen (septikemie) naar andere weefsels en organen optreden:
A. Metritis en endometritis
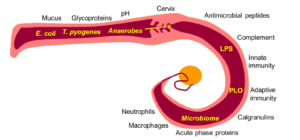
In recente studies is met 16S ribosomaal RNA gene sequencing aangetoond dat Trueperella, Fusobacteria en Provotella species deel uitmaken van de normale flora van de uterus. Postpartum baarmoederontstekingen worden dikwijls geassocieerd met de aanwezigheid van Escherichia coli, Trueperella pyogenes en anaerobe pathogene bacteriën. Hierbij is T. pyogenes meestal verantwoordelijk voor de graad van baarmoederontsteking en de daarmee gepaard gaande klinische symptomen. Dit kan verklaard worden door pyolisin, welke verantwoordelijk is voor de cytolyse van de stromale cellen van het endometrium. Het aangeboren immuunsysteem biedt een niet-specifieke en snelle reactie op deze ziekteverwekkers en de schade door hen veroorzaakt. Een overmatige ontstekingsreactie kan leiden tot endometritis.
fig. afkomstig uit Proceedings van de 33e AETE 2017
B. Abortus
Trueperella pyogenes is een omgevingsbacterie die op de huid en slijmvliezen van gezonde koeien voorkomt. Vanuit huidletsels en abcessen vindt de kiem zijn weg via de bloedbaan richting baarmoeder waar ze de baarmoederwand en de vruchtvliezen kan aantasten. Doordat het ongeboren kalf geen volwaardig immuunsysteem heeft, is het kalf vanzelfsprekend gevoeliger voor deze infectie dan het moederdier. Een septikemie kan dus sterfte van de foetus en daardoor abortus veroorzaken. Trueperella pyogenes wordt dan ook dikwijls gevonden in de longen van de foetus (prevalentie 1 – 5 %). Meestal komt deze abortus voor in het tweede deel van de dracht. Trueperella wordt hierdoor aangeduid als primaire pathogene abortusverwekker.
C. Mastitis
a. Zomerwrang
Trueperella pyogenes is samen met de anaërobe bacterie Peptococcus indolicus gekend als veroorzaker van zomerwrang. Deze zomermastitis komt voor bij vaarzen en droge koeien waarbij veroorzakers worden overgebracht van de ene koe op de andere door de vector Hydrotaea irritans. De ontstekingsreactie wordt gekenmerkt door typisch etterig secreet en een hard kwartier. Meestal verliest de koe ook haar kwartier.
b. Mastitis
Hoe langer hoe meer is men ervan overtuigd dat T. pyogenes, naast zomermastitis ook een belangrijke rol speelt in klinische mastitis. Epidemiologisch onderzoek heeft aangetoond dat klinische mastitis veroorzaakt door T. pyogenes gepaard gaat met een hoog celgetal, opmerkelijke reductie in melkgift en een hoge opruimcoëfficiënt van aangetaste koeien. Bovendien is deze kiem vaak resistent tegen diverse antibiotica gebruikt in voor mastitis geregistreerde diergeneesmiddelen.
D. Pneumonie
De kiemen die genoemd worden bij BRD in kalveren zijn steevast Mannheimia haemolytica, Pasteurella multocida, Histophilus somni en Mycoplasma bovis. Wanneer er echter sprake is van abcesvorming (meestal chronische infecties) in de long, dan wordt Trueperella pyogenes heel vaak geïsoleerd. Trueperella is soms verantwoordelijk voor het niet goed reageren van het dier op een behandeling van luchtweginfectie met een antibioticum. Niet elk antibioticum werkt goed in de omgeving van etter, maar daarnaast blijkt Trueperella regelmatig resistent te zijn voor verschillende antibiotica.
E. Abcessen
a. Leverabcessen
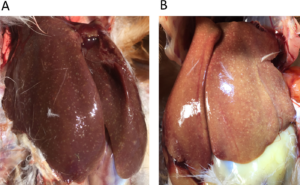
Leverabcessen komen regelmatig voor bij zowel melkvee als vleesvee. Meestal zijn deze infecties polymicrobieel, waarbij Gram-negatieve anaerobe bacteriën dominant aanwezig zijn. De meeste studies hierover geven aan dat Fusobacterium necrophorum de primaire veroorzakende kiem is. De tweede meest gevonden kiem bij leverabcessen is T. pyogenes met daarnaast nog enkele andere bekenden als Bacteroïdes spp, Clostridium spp. Klebsiella spp, en E. coli.
b. Andere abccessen
T. pyogenes wordt ook dikwijls gerelateerd aan in- en uitwendige abcessen, zoals dikke ontstoken hakken, nek-en schoftbuilen, uiersmet, necrobacillose en ontstoken klauwen.
Veel voorkomende problemen op melkveebedrijven met T. pyogenes zijn:
- Udder cleft dermatitis (UCD)
Udder cleft dermatitis ook wel bovine ulceratieve mammaire dermatitis is een aantasting van de huid die men vindt tussen de voorkwartieren en bij de overgang van de voorkwartieren naar de buikhuid. Als normaal bewoner van de huid, heeft T. pyogenes, zeker wanneer de huidbarrière is doorbroken, een rol in de aandoening. Meer en meer bedrijven hebben een probleem met UCD. Strenge hygiënische maatregelen en goede wonddesinfectie is niet altijd voldoende om deze aandoening te stoppen. - Orale necrobacillose
Dit is een necrotische ontsteking van de mucosa van de mond, keel, neus of larynx. Op sommige bedrijven komt de aandoening enzoötisch voor. - Interdigitale necrobacillose
Fusobacterium necrophorum is zeer zeker de belangrijkste pathogeen bij een interdigitaal flegmoon of interdigitale necrobacillose. Het leukotoxine is de belangrijkste virulentiefactor van deze bacterie in runderen. Maar ook andere bacteriën zoals Bacteroïdes melaninogenicus, Dichelobacter nodosus, Phorphyromonas levii, spirocheten en T. pyogenes spelen vaak een rol in deze aandoening. Een wisselwerking tussen deze verschillende pathogenen ligt hieraan ten grondslag.
Verspreiding
Vectoren zoals vliegen, maar ook een te vochtige omgeving en direct contact worden aangegeven als de voornaamste routes van verspreiding van T. pyogenes.
Diagnose
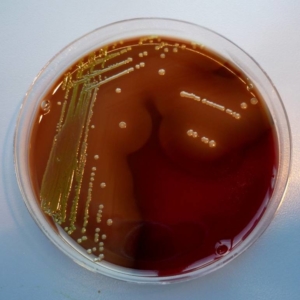
Routine diagnose is gebaseerd op microbiologische cultuur en phenotypische identificatie van de bacterie uit letsels. In een cultuur is de kiem gemakkelijk te herkennen aan zijn celmorfologie; in een cultuur op bloodagar worden de kolonies omgeven door een zone van beta-hemolyse.
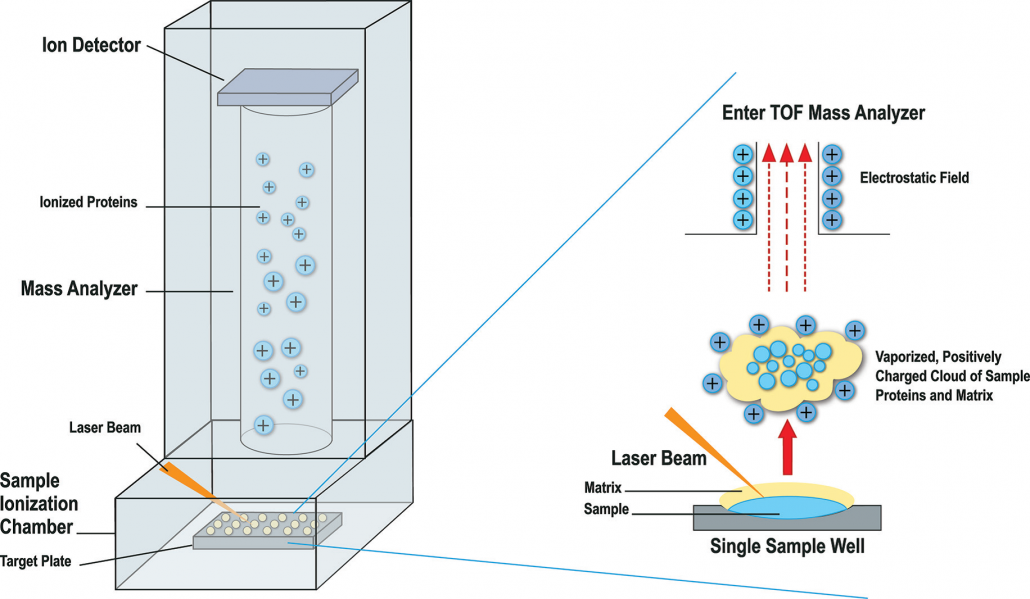
Identificatie van de bacterie door middel van MALDI-TOF MS is ook een snelle en betrouwbare methode.
Behandeling
Bij nutsdieren kan T. pyogenes serieuze economische verliezen geven. Bij runderen is deze kiem verantwoordelijk voor een daling in vlees en melkopbrengsten, maar ook voor verminderde fertiliteit en verhoogde afvoer van dieren.
Antibiotica
Antibiotica zoals beta-lactams, tetracyclines en macroliden kunnen aangewend worden om een infectie met T. pyogenes te behandelen. Toch wordt er bij een gemengde infectie in het veld regelmatig gezien dat een behandeling niet aanslaat. De reden ligt hier dan niet bij de primaire veroorzaker van het probleem maar bij een secundaire pathogeen zoals T. pyogenes die steeds meer multiresistent blijkt te zijn voor meerdere antimicrobiële middelen. Uit een 10 jaar durende retrospectieve studie uitgevoerd door Ribeiro, 2015 kwam naar voren dat T. pyogenes dikwijls resistent is voor trim-sulfa, enrofloxacines en tetracyclines. Met dit in het achterhoofd is het zeker verstandig om als diagnosetechniek niet altijd een PCR te gebruiken, maar af en toe ook zeker te gaan voor bacterieel onderzoek met antibiogrambepaling.
Er zijn geen specifieke controlemaatregelen die kunnen genomen worden ter preventie van T. pyogenes infecties.
Vaccinatie
Geregistreerde vaccins zijn niet beschikbaar. In een proef uitgevoerd op de universiteit van Cornell werd gekeken of een vaccin met E. coli, F. necrophorum en T. pyogenes bescherming kon bieden tegen puerperale metritis bij Holstein melkkoeien. De preventieve werking op het voorkomen van endometritis gebaseerd op vijf verschillende geïnactiveerde formuleringen uitgaande van verschillende combinaties van eiwitten (fimH, LKT, PLO) tot geïnactiveerde hele cellen in 3 subcutane en 2 intravaginale vaccins werd vergeleken. Uit het onderzoek bleek dat subcutane vaccinatie met geïnactiveerde bacteriële componenten en/of eiwit subunits, puerperale metritis kan voorkomen tijdens eerste lactatie van melkkoeien.
Met enige regelmatig ontvangen wij vragen over de betekenis van het isoleren van T. pyogenes uit letsels en de mogelijkheden om deze bacterie te gebruiken in een bedrijfsspecifiek vaccin. De afgelopen jaren heeft Dopharma daarom ervaring kunnen opdoen met autovaccins voor rundvee die deze kiem bevatten.
Conclusie
Ook minder bekende bacteriën zoals T. pyogenes kunnen een voorname rol spelen in het verloop van veelvoorkomende ziekteprocessen. Kennis hebben over hoe de kiem zich gedraagt in het dier of over de hoge mate van resistentie van deze kiem is daarom belangrijk.
Twijfelt u over de rol van Trueperella bij problemen die u in het veld tegenkomt? Neem dan zeker contact op met het TS-team om hierover van gedachten te wisselen.
Referenties:
1. AF. Yassin et al, 2011 – Comparative chemotaxonomic and phylogenetic studies on the genus Arcanobacterium Collins et al. 1982. Lehen et al. 2006: Proposal for Trueperella gen. nov. and emended description of the genus Arcanobacterium. Int. J Syst. Evol. Microbiology 61: 1265 – 74
2. M. Rzewuska et al. – Pathogenicity and virulence of Trueperella pyogenes: A review. Int. J. Mol. Sci. 2019, 20, 2737
3. IM. Sheldon et al. – Influence of uterine bacterial contamination after parturition on ovarian dominant follicle selection and follicle growth and function in cattle. Reproduction 2002 123, 837-845
4. EJ. Williams et al. – Clinical evaluation of postpartum vaginal mucus reflects uterine bacterial infection and the immune response in cattle. Theriogenology 2004.03.017
5. CC. Karstrup et al. – Presence of bacteria in the endometrium and placentomes of pregnant cows. Theriogenology .2017 volume 99: 41-47
6. M. Rezanejad er al. – Phenotypic and molecular characterization of antimicrobial resistance in Trueperella pyogenes strains isolated from bovine mastitis and metritis. BMC Microbiology 19: 305
7. V. Urumova et al. – Investigations on the involvement of Arcanobacterium pyogenes in various infections in productive and companion animals and sensitivity of isolates to antibacterials. Revue de medicine vétérinaire – Decembre 2009
8. BN. Bonnett et al. – Endometrial biopsy in Holstein-Friesian dairy cows. Bacteriological analysis and correlations with histological findings. Can J Vet Med 1991; 55: 168-173
9. M. Kontturi et al. – Bacterial species associated with interdigital phlegmon outbreaks in Finnish dairy herds. BMC Vet. Res. 2019, 29, 44
10. DC. Van Metre et al. – Pathogenesis and treatment of bovine foot rot. Vet. Clin. N Am-Food Cornell 2017; 33: 183 – 194.
11. MG. Ribeiro et al. – Trueperella pyogenes multispecies infections in domestic animals. Veterinary Quartely 2015, 35:2, 82-87
12. E. Rosenberg et al, – The prokaryotes Actinobacteria – Book fourth edition – Springer
13. V. Rodriguez et al. – Trueperella pyogenes, an opportunistic pathogen: A review. Revista Colobiana de Ciencia Animal 2015, Vol. 8, No. 1
14. MR. Amos et al. – Differential endometrial cell Sensitivity to cholesterol-dependent cytolisin links Trueperella pyogenes to uterine disease in cattle. Biology of reproduction 2014, 90(3): 54, 1-13
15. G. Preta et al. – Tethered bilayer membranes as a complementary tool for functional and structural studies: the pyolysin case. Biochimica et Biophysica Acta 1858 2016, 2070 – 2080.
16. R.G. Amachawadi et al. – Liver abcesses in cattle – American Society of animal Science 2016.94: 1620 -1632
17. ANA Miller et al. – The effects of A. pyogenes on endometrial function in vitro, and on uterine and ovarian function in vivo. Theriogenology 2007, 68 (7): 972 – 980.