Leververvetting bij pluimvee
Leververvetting bij pluimvee wordt in het Engels omschreven als fatty liver haemorrhagic syndrome (FLHS). Deze aandoening wordt vooral gevonden bij leghennen. Het wordt gekenmerkt door een verhoogde mortaliteit, een daling in de eiproductie en grote hoeveelheden vet in de lever. In dit artikel bieden we u een overzicht van de bekende informatie en enige recent gepubliceerde informatie over FLHS van de universiteit van Queensland.
Aetiology
FLHS is een multifactorieel syndroom, waarvoor enkele risicofactoren zijn beschreven:
- een overmaat aan energie-inname;
- hoge of lage temperaturen;
- piekproductie (oestradiol);
- lage hoeveelheid fosfolipiden in de lever;
- ontsteking;
- beperkte beweging.
Een overmaat aan energie-inname
Een overmaat aan energie-inname lijkt de meeste belangrijke risicofactor te zijn voor het ontwikkelen van FLHS. Een deel van de auteurs die over dit onderwerp hebben gepubliceerd concluderen dat de energiebron niet relevant is, maar anderen concluderen dat koolhydraatrijk voer een groter risico vormt dan vetrijk voer. De hypothese is dat dieren die een koolhydraatrijk dieet krijgen een hoge de novo vetsynthese. Bij de de novo vetzuursynthese in de lever worden vetzuren gevormd vanuit koolhydraten. Deze vetzuren kunnen daarna omgezet worden in triglyceriden of andere lipiden. Dit zet druk op het vetmetabolisme in de lever. Als de dieren een voer krijgen met een hoger vetgehalte, is de behoefte naar een de novo vetsynthese lager. FLHS komt vaker voor bij zware dieren, dan bij dieren met een normaal of lager lichaamsgewicht. Het is niet bekend of dat wordt verklaard door een overmaat aan energie-inname of door een ander mechanisme.
Hoge of lage temperaturen
Hittestress is een bekende risicofactor; FLHS komt vaker voor gedurende hete periodes. Blootstelling aan lage temperaturen kan echter ook een risicofactor zijn, die met name relevant is voor hobbymatig gehouden kippen.
Het is tot op heden niet volledig bekend waarom temperatuursextremen bijdragen aan het optreden van FLHS. In parelhoenders is wel aangetoond dat hittestress het vetmetabolisme beïnvloed, maar hier moet nog meer onderzoek naar gedaan worden. Andere hypothesen zijn de verminderde energiebehoefte bij een hogere omgevingstemperatuur of een afname van de beweging van dieren, wat ook wordt beschreven als predisponerende factor bij in kooien gehouden dieren (zie later).
Piekproductie (oestradiol)
Hoogproductieve leghennen ontwikkelen vooral FLHS tijdens de piekproductie, wat verklaart kan worden door de rol van oestradiol (oestrogeen). Hennen met FLHS hebben een hogere plasma oestradiol concentratie dan hennen zonder FLHS. Daarnaast wordt de toediening van oestradiol gebruikt om FLHS te induceren in leghennen. Dit is het meest succesvol bij hennen die ad libitium (niet beperkt) gevoerd werden.
Oestradiol stimuleert de opslag van vetten in de lever, om de dieren te voorzien van voldoende vet voor de productie van de eieren.
Lage hoeveelheid fosfolipiden in de lever
De hoeveelheid fosfolipiden die aanwezig is in de lever wordt als heel belangrijk beschouwd voor de ontwikkeling van FLHS. De fosfolipidenconcentratie bij kippen met FLHS is lager dan bij kippen die deze aandoening niet hebben. Fosfolipiden hebben een lipotrope werking en zijn dus belangrijk voor de mobilisatie van vet uit de lever. Bovendien zijn ze aanwezig in het celmembraan waar ze de integriteit en poreusheid van de membranen reguleren en de cellen beschermen. Bij het hoofdstuk preventie wordt ook nog geschreven over fosfolipiden.
Ontsteking
De onderzoeksgroep van Shini et al ontdekten dat een ontstekingsreactie kan bijdragen aan de pathogenese van FLHS bij kippen met een grote hoeveelheid vet in de lever (steatose). Deze studiegroep vond een hogere concentratie fibrinogeen en leukocyten (heterofielen en lymfocyten) in kippen met FLHS dan in controledieren. Ook was de mRNA expressie van IL-1β en IL-6 hoger. Deze cytokines zijn betrokken bij de activatie en promotie van leukocyteninfiltraties op plaatsen waar dit nodig is. De ontstekingsreactie die werd gevonden was zowel systemisch als lokaal (in de lever).
De FLHS werd in dit geval experimenteel geïnduceerd met oestradiol en LPS (lipopolysaccharide). LPS is een bestanddeel van de buitenmembraan van Gram-negatieve bacteriën, dat gebruikt kan worden voor het induceren van een immuunreactie. In deze dieren leek LPS de oorzaak voor de transitie van een simpele steatose naar FLHS. Onder commerciële omstandigheden kan een ontstekingsreactie die veroorzaakt wordt door onder andere nutritionele of omgevingsfactoren hieraan ten grondslag liggen.
Bij ons zijn nog geen studies bekend waarin is gekeken naar het effect van ontstekingsremmende medicijnen op de ontwikkeling of progressie van FLHS.
Beperkte beweging
De incidentie van FLHS is hoger bij hennen in (verrijkte) kooien, door de beperkte bewegingsvrijheid die ze in dat huisvestingssysteem hebben.
Mycotoxines
Mycotoxines zijn in het verleden ook genoemd in relatie tot FLHS, maar hun rol is twijfelachtig. Voor aflatoxine is in ieder geval aangetoond dat het andere leverafwijkingen veroorzaakt dan de afwijkingen die worden gevonden bij FLHS.
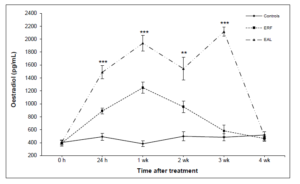
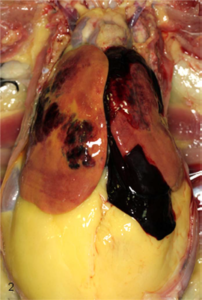
Figuur 1 Figuur uit Shini (2014) die laat zien wat het effect is van het toedienen van oestradiol aan kippen die beperkt worden in hun voeropname (ERF) of die ad libitum gevoed worden (EAL).
Het begin van FLHS
De problemen die worden veroorzaakt door FLHS, worden doorgaans gezien tijdens de piekproductie. Dit betekent echter niet dat dit leverprobleem zich ook pas op dat moment ontwikkeld; vaak is dit namelijk al in eerder stadium begonnen. De eerste veranderingen in de lever worden vaak al gezien op het moment dat de dieren in leg komen. Dit gaat gepaard met een toename in de synthese van vetten en eiwitten voor de productie van eieren. Op dit moment worden er echter vaak nog geen symptomen gezien. Deze treden pas op tijdens de piekproductie en worden waarschijnlijk geïnduceerd door oestradiol.
Gevoeligheid van vogels
FLHS is een aandoening die bij vogels relatief veel voorkomt. Hoe kan dit verklaart worden? Voor minimaal een groot deel wordt dit verklaard door verschillen tussen vogels en zoogdieren:
- Vogels hebben een slecht ontwikkeld lymfesysteem bij de darmen. De vetzuren uit de voeding komen daardoor direct in het portale bloedsysteem als VLDL’s (portomicrons). Alle portomicrons zullen de lever passeren, waardoor er sneller vetstapeling in de lever kan optreden.
- Adipocyten hebben bij vogels een veel beperktere capaciteit voor lipogenese. Dit betekent dat de lever veel meer belast wordt met deze taak dan in zoogdieren.
- Specifiek in leghennen is er een hoge vetzuurbehoefte voor de vorming van de dooier. Deze vetzuren worden geproduceerd door de novo vetzuursynthese in de lever, omdat de ovaria de portomicrons die afkomstig zijn van de darmen niet kunnen benutten. De hoge productie van vetzuren in de lever betekent ook dat er veel vetzuren gemobiliseerd moeten worden. Omdat dit vaak een langzamer proces is, kunnen deze vetzuren zich ophopen in de lever. Daarnaast kan de opname van VLDL’s door de ovaria trager zijn dan de mobilisatie vanuit de lever, wat leidt tot een toename van circulerende triglyceriden.
Hobbymatig gehouden dieren
FLHS is niet alleen een aandoening die gezien wordt bij bedrijfsmatig gehouden pluimvee. Het is tevens een belangrijke oorzaak van sterfte in hobbykippen. Dit geldt vooral voor kippen in een overmatige conditie. In het voorjaar zal het oestradiolgehalte toenemen door de stijging van de eiproductie. Daarnaast neemt de omgevingstemperatuur toe. Door deze combinatie van factoren treedt FLHS bij hobbykippen vooral op in deze maanden.
Symptomen
FLHS in een koppel kenmerkt zich meestal door een plotselinge toename in mortaliteit ondanks geode legpercentages. Sterfte treedt vooral op bij dieren die volledig in productie waren. De gemiddelde mortaliteit is 3 – 5%, maar hogere cijfers zijn ook gemeld. Kippen die dood gevonden worden, zijn vaak bleek maar hebben verder geen klinische verschijnselen vertoond. In sommige gevallen wordt er echter wel een (plotselinge) daling van de eierproductie gezien.
Het is lastig om bij levende dieren een onderscheid te maken tussen gezonde hennen en hennen met FLHS; bleke kammen is een mogelijk verschijnsel maar dit wordt ook niet bij alle dieren gezien.
Autopsie
Bij autopsie op dood aangetroffen dieren wordt in de buikholte vaak een groot bloedstolsel gevonden, dat afkomstig is uit de lever. Er kunnen ook enkele afwijkingen gevonden worden aan de lever:
- hepatomegaly;
- een grote hoeveelheid vet in de lever. Bij FLHS kan de lever voor 50-60% bestaan uit vet, maar in sommige gevallen is zelfs een vetgehalte van 70% gemeld;
- een afwijkende kleur die is omschreven als geel, bleek of stopverfkleurig;
- brosheid van het leverweefsel;
- kleine hematomen in het leverparenchym die zowel gevonden kunnen worden bij dood gevonden als geëuthanaseerde dieren. Deze bloedingen worden vaak in de randen van de leverkwabben gezien.
Grote hoeveelheden vet worden niet alleen in de lever, maar ook rond de andere organen in de buikholte gevonden. De ovaria zijn vaak actief; alleen bij dieren die al langer problemen hebben, worden inactieve ovaria gevonden.
Herstel van het leverparenchym leidt tot fibrose. Dit kan worden waargenomen bij kippen die eerder FLHS hebben doorgemaakt. Als een koppel meerdere milde episodes van FLHS doormaakt, kan dit ook resulteren in het herhaaldelijk optreden van fibrose in de lever. Deze stapeling van fibrotisch weefsel kan leiden tot een verminderde leverfunctie.
Hoe leidt een overmatige hoeveelheid vet in de lever tot een plotselinge bloeding? Eén hypothese is dat de grote hoeveelheid vet de architectuur van de lever verstoord en daarmee leidt tot een verzwakking van het netwerk van reticulaire vezels en bloedvaten. Een andere mogelijke verklaring is de focale necrose van hepatocyten, waardoor vaatschade op kan treden. Tot slot kan een mogelijke oorzaak worden gezocht in overmatige vetoxidatie van onverzadigde vetzuren in de lever. Dit kan zorgen voor het mechanisme dat zorgt voor herstel van de cellen, waardoor weefselschade op kan treden.
Diagnose
Afgezien van de klinische symptomen en necropsie, zijn er geen eenvoudige diagnostische mogelijkheden beschikbaar. Door de moeilijkheid van het stellen van de diagnose in levende dieren en het ontbreken van deze testen, wordt deze aandoening waarschijnlijk regelmatig over het hoofd gezien.
Preventie
Zoals in de eerste paragraaf ook al werd beschreven is FLHS een multifactoriële aandoening. Preventie van deze aandoening bestaat dus vooral uit het voorkomen van de factoren die een rol spelen bij het ontstaan. Een van de beschreven predisponerende factoren is de fosfolipidenconcentratie. Choline kan hier een belangrijke rol in spelen.
Fosfolipiden en choline
Fosfolipiden zijn structurele lipiden, het zijn bouwelementen van de cellen. Lecithine is de belangrijkste fosfolipide en maakt een integraal deel uit van de structuur van lipoproteïnen en microsomale membranen. Het speelt dan ook een essentiële rol in de vorming van ‘very low density lipoproteins (VLDLs) en is daardoor belangrijk voor het transport van vet van de lever naar andere weefsels. Een lecithine deficiëntie wordt geassocieerd met de ophoping van vet in de lever en een afname van de hoeveelheid vet die wordt gebruikt voor de vorming van de dooiers.
Choline (fosfatidylcholine) is een van de belangrijkste componenten van lecithine. Choline is dus ook belangrijk voor het metaboliseren en mobiliseren van triglyceriden in de lever. Het wordt dan ook een lipotrope factor genoemd. Daarnaast is het ook belangrijk voor de benutting van vetten.
Het supplementeren van choline bij leghennen wordt geassocieerd met een toename van de VLDL-concentratie in het serum en een afname van vet dat is opgeslagen in het hart, de lever en de buikholte. De combinatie van deze factoren zorgt ervoor dat het kan bijdragen aan de preventie van een abnormale vetophoping in hepatocyten, de zogenaamde leververvetting.
De cholinebehoefte van kippen is afhankelijk van het dieet; een dieet met een hoog vetgehalte gaat gepaard met een hogere cholinebehoefte. Daarnaast kan het supplementeren van choline vooral interessant zijn tijdens periodes met hittestress, omdat de afzetting van vet in de lever significant toeneemt bij hogere temperaturen.
Choline kan op verschillende manieren worden aangeboden, maar omdat FLHS een ernstige aandoening is, wordt aangeraden snel te handelen. Het toedienen van choline via het drinkwater is dan in de meeste situaties de beste oplossing.
Dopharma heeft een aanvullend diervoeder met choline, in combinatie met betaïne, methionine, lysine, sorbitol en plantenextracten. Dit vloeibare product Heparenol is zeer geschikt voor gebruik in drinkwater bij pluimvee.
Literatuur
- Alagawany, M., El-Hindawy, M. Attia, A., Farag, M., Abd El-Hack, M. (2015) Influence of dietary choline levels on growth performance and carcass characteristics of growing Japanese quail. Advances in animal and veterinary science 3(2): 109-115.
- Barroeta, A.C., Baucells, M.D., Blanco Pérez, A., Calsamiglia, S., Casals, R., Cepero Briz, R., Davin, R., Gonzalez, G., Hernandez, J.M., Isabel, B., Lopez Bote, C., Rey, I.A., Rodriguez, M., Sanz, J., Soto-Salanova, M.F., Weber, G. (2012) Optimum vitamin nutrition – In the production of quality animal foods.
- Crespo, R. (2020) Fatty liver hemorrhagic syndrome in poultry. https://www.merckvetmanual.com/poultry/fatty-liver-hemorrhagic-syndrome/fatty-liver-hemorrhagic-syndrome-in-poultry?query=fatty%20liver Consulted February 5th
- Crespo, R., Shivaprasad, H.L. (2008) Developmental, metabolic, and other noninfectious disorders. Chapter 30 in Diseases of Poultry, 12th edition, Edited by Saif, Y.M.
- Dong, X.F., Zhai, Q.H., Tong, J.M. (2019) Dietary choline supplementation regulated lipid profiles of egg yolk, blood, and liver and improved hepatic redox status in laying hens. Poultry science 98: 3304-3312.
- Gilman, G.G. e.a. (1990) Choline. In: The pharmaceutical basis of therapeutics, p 1542-1544.
- Griffith, M., Olinde, A.J., Schexnailder, R., Davenport, R.F., McKnight, W.F. (1969) Effect of choline, methionine and vitamin B12 on liver fat, egg production and egg weight in hens. Poultry science 48(6): 2160–2172.
- Hossain, M.E., Das, G.B. (2014) Effects of supplemental choline on deposition of cardiac, hepatic and abdominal fat in broiler. Bangladesh journal of animal science 43(2): 118-122.
- Howard, J.L. (1986) Vitamins in food animal nutrition. Current Veterinary Therapy, Food Animal Practice 290.
- Igwe, I.R., Okonkwo, C.J., Uzoukwu, U.G., Onyenegecha, C.O. (2015) The effect of choline chloride on the performance of broiler chickens. Annual research & review in biology 8(3).
- Kahn, C.M. (2005) The Merck Veterinary Manual 9th Chapter Poultry – Fatty liver syndrome page 2226-2227.
- Khosravinia, H., Chethen, P.S., Umakantha, B., Nourmohammadi, R. (2015) Effects of lipotropic products on productive performance, liver lipid and enzymes activity in broiler chickens. Poultry science journal 3(2): 113-120.
- Kpodo, K.R. (2015) Dietary supplementation of choline and betaine in heat-stressed broilers. Thesis for the master of science degree at the University of Tennessee, Knoxville.
- Krishnan Rajalekshmy, P. (2010) Effects of dietary choline, folic acid and vitamin B12 on laying hen performance, egg components and egg phospholipid composition. Theses and dissertations in animal science. 21.
- March, B.E. (1981) Choline supplementation of layer diets containing soybean meal or rapeseed meal as protein supplement. Poultry science 60: 818-823.
- Mendoca, C.X., Guerra, E.M., de Oliveira, C.A. (1989) Suplementação de colina para poedeiras comerciais Hisex Brown e hisex White. 2. Deposição de gordura hepática e níveis de lipídeos plasmáticos. Revista da faculdade de medicina veterinaria e zootecnia da universidade de Sao Paolo 26(1): 93-103.
- Ramo Rao, S.V., Sunder, G.S., Reddy, M.R., Praharaj, N.K., Raju, M.V., Panda, A.K. (2001) Performance of broiler chicken in early life on methionine deficient feed with added choline and betaine. British poultry science 42(3): 362-367.
- Saeed, M., Alagawany, M., Asif Arain, M., El-Hack, M.E.A., Dhama, K. (2017) Beneficial impacts of choline in animal and human with special reference to its role against fatty liver syndrome. Journal of experimental biology and agricultural sciences 5(5): 589-598.
- Schexnailder, R., Griffith, M. (1973) Liver fat and egg production of laying hens as influenced by choline and other nutrients. Poultry science 52: 1188-1194.
- Shini, S. (2014) Fatty liver haemorrhagic syndrome in laying hens: field and experimental investigations. A thesis submitted for the degree of Doctor of Philosophy at The University of Queensland.
- Shini, S., Shini, A., Bryden, W.L. (2019a) Unravelling fatty liver haemorrhagic syndrome: 1. Oestrogen and inflammation. Avian pathology 49(1): 87-98.
- Shini, S., Shini, A., Bryden, W.L. (2019b) Unravelling fatty liver haemorrhagic syndrome: 2. Inflammation and pathophysiology. Avian pathology 49(2): 131-143.
- The poultry site – fatty liver haemorrhagic syndrome. 06-05-2020. https://thepoultrysite.com/articles/fatty-liver-haemorrhagic-syndrome
- Trott, K.A., Giannitti, F., Rimoldi, G., Hill, A., Woods, L., Barr, B., Anderson, M., Mete, A. (2014) Fatty liver hemorrhagic syndrome in the backyard chicken: a retrospective histopathological case series. Veterinary pathology 51(4): 787-795.
- Whitehead, C.C. (1979) Nutritional and metabolic aspects of fatty liver disease in poultry. The veterinary quarterly 1(3): 150-157.
- Workel, H.A., Keller, T., Reeve, A., Lauwaerts, A. (2002) Choline – the rediscovered vitamin for poultry. The poultry site. https://thepoultrysite.com/articles/choline-the-rediscovered-vitamin-for-poultry.