Vitamines als ondersteuning bij rundvee; immuniteit, mastitis en vruchtbaarheid
Het is algemeen bekend dat vitaminen belangrijk zijn voor een goede diergezondheid. In het kader van de reductie van het antibioticumgebruik worden aanvullende diervoeders steeds vaker ingezet om problemen te voorkomen. Maar welke vitamines kunnen op welk moment ingezet worden? Om u te ondersteunen bij het correcte gebruik van vitamines wordt in dit artikel beschreven welke vitamines mogelijk een rol spelen bij de immuniteit, mastitis en vruchtbaarheid bij rundvee.
Dit is zeker geen volledig overzicht; effecten op productie en effecten op andere factoren worden hier niet besproken. Voor meer informatie over de literatuur betreffende vitaminen en mineralen bij rundvee en andere diersoorten verwijzen we u naar dit literatuuroverzicht.
De basale behoefte van vitaminen bij rundvee
Het op een effectieve manier toedienen van vitaminen is echter geen eenvoudige zaak. Zo zijn vitaminenbehoeften niet altijd goed gedefinieerd. Meestal wordt gebruik gemaakt van de behoeften zoals opgesteld door het Amerikaanse ‘National Research Council (NRC)’ [2, 3]. Deze waardes zijn echter vaak gebaseerd op oude studies [4].
Het gebrek aan recente gegevens wordt verklaard door het feit dat het bepalen van een exacte behoefte lastig is; hiervoor moeten titratiestudies uitgevoerd worden, waarbij gekeken wordt bij welke hoeveelheid van de vitamine geen effect meer optreedt op een bepaalde parameter. In de meeste studies worden echter slechts één of twee doseringen vergeleken. Daarnaast is de behoefte afhankelijk van andere factoren, niet alleen het totale rantsoen, maar bijvoorbeeld ook het productiestadium [5]. Zo kunnen bepaalde behoeften hoger zijn tijdens risicoperioden zoals afkalven of piekproductie. Tot slot hebben koeien grotere reserves van vitaminen dan bijvoorbeeld knaagdieren, waardoor de studieperiodes lang zouden moeten zijn.
Om het een en ander nog gecompliceerder te maken speelt bij rundvee ook de pens een belangrijke rol in de farmacokinetiek van vitaminen. In de pens worden door micro-organismen verschillende vitaminen geproduceerd; voorbeelden hiervan zijn vitaminen B1, B2, B5, B6, B12, biotine, foliumzuur, inositol en niacine [2, 3, 6, 7]. Omdat vaak wordt aangenomen dat de productie van deze vitaminen de behoefte wel zal dekken, worden er nauwelijks studies uitgevoerd [2, 3].
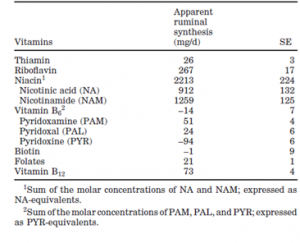
De micro-organismen in de pens zorgen echter niet alleen voor de productie van vitaminen, maar ook voor de afbraak van vitaminen, waaronder choline, foliumzuur, vitamine A, B-vitaminen en vitamine C [1-3, 7-9]. Dit wordt bevestigd door Flachowsky et al, die aantonen dat zowel de orale als parenterale toediening van vitamine A aan kalveren en vleesvee leidt tot een significante toename van de vitamine A concentratie in de lever (resp. +48.6 µmol/kg en +85.4 µmol/kg), maar dat de stijging na parenterale toediening significant hoger is [10]. Santschi et al hebben onderzocht wat de schijnbare productie van de verschillende B-vitaminen in de pens is. Dit wordt weergegeven in Figuur 1 [1]. De invloed van de pens is natuurlijk pas aanwezig wanneer koeien gaan herkauwen. Jonge, niet herkauwende dieren, zullen deze vitaminen voor een deel via de biest opnemen maar moeten de rest via de kalvermelk binnenkrijgen.
Figuur 1 Schijnbare synthese van B-vitaminen in de pens [1]
De stabiliteit van vitamine D en E in de pens is aangetoond door Hymoller en Jensen [11]. Voor vitamine E wordt zelfs gesuggereerd dat de orale toediening effectiever is dan parenterale toediening in verband met een lokale reactie op de plaats van injectie [12].
Vitamine C wordt endogeen geproduceerd in de lever. Pasgeborenen en kalveren in de eerste levensweken zijn hier echter nog niet toe in staat [13].
Het gebruik van vitaminen tijdens risicoperioden
Als er gekeken wordt naar specifieke risicoperioden waarin het gebruik van vitaminen voordelen voor de gezondheid en/of productie kan hebben, zijn er tal van mogelijkheden. Hieronder zal de invloed voor zover bekend op het immuunsysteem en meer specifiek op de vruchtbaarheid en uiergezondheid worden besproken. Voor informatie over het gebruik van vitaminen tijdens andere risicoperioden wordt verwezen naar het literatuuroverzicht.
Immuniteit
Vitamine A
Vitamine A draagt bij aan de functie van epitheelcellen en stimuleert het immuunsysteem [8]. Een lage vitamine A concentratie in het dieet resulteert in een verminderde IgG1 respons tegen een geïnactiveerd coronavirusvaccin. Dit duidt op een daling van de Th2 geassocieerde antilichaamproductie [14]. Verhoogde toediening van Vitamine A tijdens de droogstand verbetert onder andere de immuniteit rond afkalven [7]. Er zijn twee studies waarin aanbevolen wordt om de behoefte zoals beschreven door het NRC met 50% te verhogen tijdens deze periode [4, 15].
Vitamine B2
Vitamine B2, of riboflavine, is vooral belangrijk voor de activiteit van neutrofielen. Intramusculaire toediening van 10 mg vitamine B2 aan koeien of 5 mg aan kalveren zorgt voor een stijging van het aantal én de activiteit van neutrofielen [16]. Ook na een eenmalige intraveneuze injectie met 2,5-5 mg vitamine B2 of drie dagelijkse injecties van 2,5 mg vitamine B2 wordt de activiteit van neutrofielen gestimuleerd [17].
Vitamine C
Een vitamine C deficiëntie leidt tot een lagere concentratie lymfocyten en monocyten [18]. Het toedienen van vitamine C aan kalveren die geen vitamine C via de voeding krijgen leidt tot een verhoging van de IgG concentratie. Bij kalveren die voldoende vitamine C via de voeding kregen werd dit effect echter niet bereikt [19].
Bij kalveren met luchtwegproblemen resulteerde de toediening van vitamine C tegelijk met een antibioticumbehandeling in een daling van de mortaliteit [20]. In een andere studie resulteerde het toedienen van vitamine C tot een vermindering van oog- en neusuitvloeiing, maar ook tot een vermindering van de activiteit van neutrofielen. Gelijktijdige toediening van vitamine E compenseerde echter voor laatstgenoemd effect [21].
Vitamine D3
Vitamine D3 is betrokken bij de functie van het immuunsysteem door stimulatie van de humorale immuniteit en remming van de celgemedieerde immuniteit [8].
Vitamine E
Vitamine E is een belangrijke antioxidant en is ook belangrijk bij de bescherming van celmembranen tegen peroxiden. Deze worden bij een ontstekingsreactie onder andere geproduceerd tijdens fagocytose [8]. Daarnaast stimuleert vitamine E de productie van antilichamen en versterkt het op deze manier de immuunreactie [7].
Bij kalveren is vooral onderzoek gedaan naar het effect van vitamine E op het verloop van luchtweginfecties. Het is aangetoond dat de toediening van vitamine E leidt tot een daling in de behandelkosten gerelateerd aan longaandoeningen [22]. Duff en Galyean concludeerden twee keer dat de toediening van vitamine E de morbiditeit ten gevolge van luchtwegaandoeningen verlaagt [23]. Daarnaast zijn er nog twee studies, waarbij wel een positief effect werd gevonden bij toediening van 1140 IE per dag [24], maar niet bij toediening van 550 IE per dag [25].
Daarnaast is aangetoond dat de toediening van vitamine E leidt tot een significante toename in IgM concentratie en ook een trend richting een hogere IgG concentratie [26, 27]. Reddy et alconcludeerden dat het effect van de toediening van 125 IE vitamine E per dag economisch rendabel is wanneer gekeken wordt naar het effect op het immuunsysteem [28]. Carter et al evalueerden de behandelkosten van nieuw aangekomen kalveren als maatstaaf voor het effect van vitamine E op het immuunsysteem. In een studie met 694 kalveren resulteerde de toediening van 2000 IE vitamine E per dag gedurende 28 dagen in een afname van de medische kosten met 22,4% en een return of investment van $0,38 per behandeld dier [29].
Bij melkkoeien wordt vitamine E in de meeste studies toegediend in de periode rond het afkalven. In een review wordt geconcludeerd dat de parenterale toediening van vitamine E in de peri-partum periode consequent leidt tot een verbeterde functie van neutrofielen [4]. In één studie is aangetoond dat de subcutane toediening van 3000 IE vitamine E vijf en tien dagen voor de verwachte afkalfdatum leidt tot een verbeterde effectiviteit van neutrofielen om bacteriën te doden, terwijl de orale toediening van 1040 IE per dag geen effect op de neutrofielenactiviteit had [30].
Mastitis
Vitaminen waarvan beschreven is dat ze van invloed zijn op de prevalentie of het verloop van mastitis bij rundvee zijn choline, vitaminen A, B1, C en E.
O’Rourke beschreef dat het effect van vitaminen op de uiergezondheid waarschijnlijk veroorzaakt wordt door beïnvloeding van het immuunsysteem [31].
Choline
Het effect van het toedienen van choline op het voorkomen en de ernst van mastitis is slechts in één studie onderzocht. Hierin is gevonden dat 15 gram choline per dag leidt tot een daling van de prevalentie en ernst van mastitis bij koeien, maar bij vaarzen werden minder eenduidige resultaten verkregen [32].
Vitamine A
Een lage plasma vitamine A concentratie (<80 µg/ml) wordt gerelateerd aan een verhoogde incidentie van mastitis [31]. Het toedienen van vitamine A kan bijdragen aan een daling van het celgetal en een reductie van de incidentie van mastitis [8]. Het effect van vitamine A toediening tijdens de droogstand wordt gekoppeld aan uiergezondheid via een effect op de immuniteit [7]. In één studie kon geen effect worden aangetoond van vitamine A toediening in de droogstand op het voorkomen van mastitis [33].
Vitamine B2
Er is slechts één studie gevonden waarin vitamine B2 in relatie werd gebracht met de uiergezondheid. Het parenteraal toedienen van 2,5 mg vitamine B2 gedurende drie dagen resulteerde in een significant sterkere daling van het celgetal. Er was geen effect op de bacteriologische genezing [17].
Vitamine C
De vitamine C concentratie in melk correleert met de duur van mastitis, de lichaamstemperatuur, de daling in melkproductie en het aantal E.coli bacteriën dat uit het geïnfecteerde kwartier wordt geïsoleerd. In deze studie was er ook een relatie tussen deze parameters en de plasma vitamine C concentratie, maar deze was niet significant [34]. Het twee keer intraveneus toedienen van 25 mg vitamine C na het induceren van experimentele mastitis leidt tot een beter herstel van de melkproductie [35]. Het subcutaan toedienen van 25 mg vitamine C gedurende vijf dagen leidt tot een sneller herstel van klinische mastitis in dieren die eveneens met een intramammair antibioticum worden behandeld [36]. Het effect van vitamine C op de genezing van mastitis wordt volgens Calsamiglia en Rodriguez verklaard door stimulatie van neutrofielen [8].
Vitamine E
Het best onderzochte vitamine als het gaat om uiergezondheid en mastitis is vitamine E. Een mogelijke verklaring voor het effect van vitamine E op uiergezondheid is het voorkomen van de daling van neutrofielen chemotaxis rond het afkalven [37, 38]. Politis et al hebben twee studies gepubliceerd waarin besproken wordt dat koppels koeien, die via de voeding minder dan 23 IE vitamine E per kg droge stof kregen, een verhoogde incidentie van klinische mastitis hadden. In dezelfde artikelen wordt geconcludeerd dat er verschillende studies zijn waarin wordt aangetoond dat het toedienen van 1000-4000 IE vitamine E per dag leidt tot een daling in de mastitisincidentie, een daling van het celgetal en een verbetering van de oxidatieve stabiliteit van de melk.
Het wordt aanbevolen om tijdens de droogstand 1000-3000 IE per dag toe te dienen en 500-1000 IE per dag tijdens lactatie. Op bedrijven met reeds bekende uiergezondheidsproblemen wordt aanbevolen om tijdens de droogstand de hoogste concentratie toe te passen [39, 40]. Er zijn meerdere studies waarin wordt aangetoond dat 1000 IU per dag leidt tot een daling van de incidentie van mastitis [4, 41].
Smith et al toonden specifiek aan dat de incidentie van mastitis daalde met 37% en de duur van de behandeling met 62% nadat de koeien tijdens de droogstand van 60 dagen per dag 1000 IU vitamine E hadden gekregen [42]. Andere specifieke cijfers worden genoemd in O’Rourke et al: een daling in incidentie van intramammaire en klinische infecties met respectievelijk 14% en 30% en een daling van het celgetal met 0,70 [31]. Weiss et al heeft drie doseringen vitamine E getest: 100, 1000 en 4000 IE per dag. Wanneer de hoogste concentratie gebruikt werd daalde de incidentie van klinische mastitis met 80% en de incidentie van intramammaire infecties met 60%. Dit effect was het duidelijkst in vaarzen [43]. Een daling in het celgetal is ook gevonden in een studie waar 2000 IE vitamine E per dag werd vergeleken met een controlegroei die 1000 IE kreeg [44].
In tegenstelling tot bovenstaande studies is er ook een onderzoeksgroep die gepubliceerd heeft dat het toedienen van 3000 IE vitamine E per dag juist een risicofactor is voor het ontwikkelen van klinische en subklinische mastitis [45]. Deze auteurs verklaren dit effect door een toename van vrije radicalen na het toedienen van deze vitamine [46]. Politis et al hebben vervolgens onderzoek gedaan naar de relatie tussen de α-tocopherol concentratie in het plasma, de incidentie van mastitis en biomarkers voor oxidatieve stress. Deze auteurs hebben geconcludeerd dat de α-tocopherol concentratie in plasma omgekeerd gecorreleerd is aan de biomarkers van oxidatieve stress in de post partum periode en de incidentie van mastitis. De reductie in incidentie van mastitis die door de meeste auteurs wordt gevonden kan volgens deze auteurs dus niet verklaard worden door een reductie van oxidatieve stress reactie [40].
Tot slot is er nog één studie waarin het toedienen van 3000 mg vitamine E geen effect had op het optreden van klinische mastitis [47].
Vruchtbaarheid
Biotine
De toediening van 20 mg biotine per dag aan koeien tijdens de eerste lactatie resulteerde in een daling van het aantal open dagen en het aantal benodigde inseminaties [48].
Niacinamide
Ook het toedienen van niacinamide kan een daling van het aantal open dagen tot gevolg hebben [49].
Vitamine A
Vitamine A is de belangrijkste vitamine in het kader van vruchtbaarheid [5, 7]. Dit vitamine is vooral belangrijk voor de normale groei en ontwikkeling van de foetus, maar het beïnvloed ook andere aspecten van de vruchtbaarheid bij zowel koeien als stieren [7, 50]. Een vitamine A deficiëntie bij drachtige koeien kan leiden tot lagere drachtigheidspercentages, een verhoogde incidentie van abortus en retentio secundinarum en de geboorte van zwakke, dode of blinde kalveren.
Het toedienen van 200 IE vitamine A per kg lichaamsgewicht leidt tot een daling van de incidentie van retentio secundinarum [8]. Ook de tochtdetectie zou verbeteren wanneer vitamine A in hoge concentraties wordt gebruikt [51]. In een oude studie is aangetoond dat de vitamine A toediening kan leiden tot een betere vruchtbaarheid bij melkkoeien en een betere overleving van de geboren kalveren [52].
Mogelijk worden de effecten van vitamine A op de vruchtbaarheid deels verklaard door een verbetering van de immuniteit [8].
Bij mannelijke dieren kan een vitamine A deficiëntie resulteren in een vertraging van de ontwikkeling, een vermindering van de libido en een verminderde spermatogenese [5].
B-vitaminen
Ook de verschillende B-vitaminen zouden een rol spelen in de vruchtbaarheid; een deficiëntie van foliumzuur, vitamine B2, pantotheenzuur, choline of vitamine B12 kan leiden tot het spontaan afbreken van een dracht [5]. Ook is aangetoond dat een wekelijkse intramusculaire toediening van een combinatie van 320 mg foliumzuur met 10 mg vitamine B12 in de periode van drie weken voor afkalven tot acht weken na afkalven leidt tot een daling van de incidentie van dystocia met 50% en een vermindering van de periode tot de eerste inseminatie in koeien in de tweede lactatie of hoger [53].
Vitamine C
Vitamine C is belangrijk voor de vruchtbaarheid van zowel koeien als stieren. Bij koeien kan vitamine C in 60% van de gevallen bijdragen aan het in stand houden van de dracht bij dieren die daar voorheen problemen mee hadden. Bij stieren is dit vitamine gebruikt bij dieren die veelvuldig werden ingezet en hierdoor slechtere bevruchtingspercentages behaalden. De spermakwaliteit veranderde van dun, waterig en passief sperma naar sperma met een normaal, visceus voorkomen en goede motiliteit [5].
Vitamine D
De effecten van vitamine D op de vruchtbaarheid zijn wat minder duidelijk dan de effecten van sommige andere vitaminen. In een review van Weiss et al wordt geconcludeerd dat de toediening van vitamine D leidt tot een lichte verbetering van de vruchtbaarheid [4]. De periode tot de eerste oestrus postpartum zou verbeteren, maar zonder effect op het aantal dekkingen dat nodig is [5]. Op de preventie van retentio secundinarum heeft vitamine D geen invloed [54].
Vitamine E
Ook vitamine E is belangrijk voor de postpartum vruchtbaarheid [55]. In een meta-analyse [56] en een review [41] wordt geconcludeerd dat de toediening van vitamine E tijdens de droogstand zorgt voor een daling van de incidentie van retentio secundinarum. Ook in het hoofdstuk van Casals & Calsamiglia wordt naast een algemeen positief effect op de vruchtbaarheid een positief effect op de incidentie van retentio secundinarum beschreven [7].
Le Blanc et al toonden ook aan dat de subcutane vitamine E toediening tijdens de droogstand de prevalentie van retentio secundinarum verminderd bij koeien met een marginale vitamine E voorziening, maar niet bij koeien die voldoende vitamine E via het voer krijgen [57]. Ook een eenmalige injectie met 3000 IE vitamine E twee weken voor de verwachte afkalfdatum blijkt effectief in het verminderen van de incidentie van retentio secundinarum en metritis [47]. In een andere studie werd al aangetoond dat een eenmalige injectie met 3000 IE vitamine E leidt tot een stijging van de plasmaconcentratie met 0,4-0,5 µg/ml, terwijl een stijging van 1 µg/ml de incidentie van retentio secundinarum met 20% kan verlagen [58].
De toediening van 1000 IE vitamine E per dag gedurende de droogstand leidt ook tot een verkorting van de periode tot de eerste oestrus van 60 naar 42 dagen en het aantal open dagen van 71 naar 62 dagen [59]. Met dezelfde dosering vitamine E worden in een andere studie vergelijkbare resultaten verkregen, maar hier wordt wel de voorwaarde gesteld dat er voldoende selenium beschikbaar moet zijn [4]. In een andere studie werd ook een daling van het aantal open dagen aangetoond, maar dan bij een dosering van 2000 IE/dag gedurende twee weken voor tot één week na het afkalven [44].
Dopharma
Dopharma heeft ook enkele diergeneesmiddelen met vitaminen in het assortiment, die gebruikt kunnen worden bij rundvee.
- Vitasol multi is een vloeibaar product met vitamines.
- Vitaminsol multi is een poedervormig product met een combinatie van vitamines en mineralen/spoorelementen.
- Vitasol® C is een geregistreerd diergeneesmiddel met vitamine C.
Referenties
- Santschi, D.E., et al., Fate of supplementary B-vitamins in the gastrointestinal tract of dairy cows. J Dairy Sci, 2005. 88(6): p. 2043-54.
- NRC, Nutrient Requirements of Dairy Cattle. 7th ed. 2001, Washington DC: National Academy of Science, National Research Council.
- NRC, Nutrient Requirements of Beef Cattle. 7th ed. 2000, Washington DC: National Academy of Science, National Research Council.
- Weiss, W.P., Requirements of fat-soluble vitamins for dairy cows: a review. J Dairy Sci, 1998. 81(9): p. 2493-501.
- Hurley, W.L. and R.M. Doane, Recent developments in the roles of vitamins and minerals in reproduction. J Dairy Sci, 1989. 72(3): p. 784-804.
- Zinn, R.A. B-vitamins in beef cattle nutrition. in Minnesota Nutrition Conference: Takeda Technical Symposium. 1992. Minnesota.
- Casals, R. and S. Calsamiglia, Optimum vitamin nutrition beef cattle, in Optimum vitamin nutrition; in the production of quality animal foods. 2012, 5M Publishing: United Kingdom. p. 309-331.
- Calsamiglia, S. and M. Rodriguez, Optimum vitamin nutrition in dairy cattel, in Optimum vitamin nutrition; in the production of quality animal foods. 2012, 5M Publishing: United Kingdom. p. 335-385.
- Hidiroglou, M., Technical note: forms and route of vitamin C supplementation for cows. J Dairy Sci, 1999. 82(8): p. 1831-3.
- Flachowsky, G., et al., The effectiveness of oral and parenteral vitamin A doses in growing cattle with different vitamin A supplies. Arch Exp Veterinarmed, 1991. 45(1): p. 93-100.
- Hymoller, L. and S.K. Jensen, Stability in the rumen and effect on plasma status of single oral doses of vitamin D and vitamin E in high-yielding dairy cows. J Dairy Sci, 2010. 93(12): p. 5748-57.
- Galyean, M.L., L.J. Perino, and G.C. Duff, Interaction of cattle health/immunity and nutrition. J Anim Sci, 1999. 77(5): p. 1120-34.
- Hemingway, D.C., Vitamin C in the prevention of neonatal calf diarrhea. Can Vet J, 1991. 32(3): p. 184.
- Jee, J., et al., Effects of dietary vitamin A content on antibody responses of feedlot calves inoculated intramuscularly with an inactivated bovine coronavirus vaccine. Am J Vet Res, 2013.74(10): p. 1353-62.
- Puvogel, G., et al., Effects of an enhanced vitamin A intake during the dry period on retinoids, lactoferrin, IGF system, mammary gland epithelial cell apoptosis, and subsequent lactation in dairy cows. J Dairy Sci, 2005. 88(5): p. 1785-800.
- Osame, S., S. Araki, and M. Kimura, Effects of vitamin B2 on neutrophil functions in cattle. J Vet Med Sci, 1995. 57(3): p. 493-5.
- Sato, S., H. Hori, and K. Okada, Effect of vitamin B2 on somatic cell counts in milk of clinical Staphylococcus aureus mastitis. J Vet Med Sci, 1999. 61(5): p. 569-71.
- Seifi, H.A., et al., Effect of short term over-supplementation of ascorbic acid on hematology, serum biochemistry, and growth performance of neonatal dairy calves. Food Chem Toxicol, 2010.48(8-9): p. 2059-62.
- Cummins, K.A. and C.J. Brunner, Dietary ascorbic acid and immune response in dairy calves. J Dairy Sci, 1989. 72(1): p. 129-34.
- Cusack, P.M., N.P. McMeniman, and I.J. Lean, Effects of injectable vitamins A, D, E and C on the health and growth rate of feedlot cattle destined for the Australian domestic market. Aust Vet J, 2008. 86(3): p. 81-7.
- Eicher-Pruiett, S.D., et al., Neutrophil and lymphocyte response to supplementation with vitamins C and E in young calves. J Dairy Sci, 1992. 75(6): p. 1635-42.
- Carter, J.N., et al., Relationship of vitamin E supplementation and antimicrobial treatment with acute-phase protein responses in cattle affected by naturally acquired respiratory tract disease.Am J Vet Res, 2002. 63(8): p. 1111-7.
- Duff, G.C. and M.L. Galyean, Board-invited review: recent advances in management of highly stressed, newly received feedlot cattle. J Anim Sci, 2007. 85(3): p. 823-40.
- Rivera, J.D., et al., Effects of supplemental vitamin E on performance, health, and humoral immune response of beef cattle. J Anim Sci, 2002. 80(4): p. 933-41.
- Stanford, K., et al., Acute interstitial pneumonia in feedlot cattle: effects of feeding feather meal or vitamin E. Can J Vet Res, 2007. 71(2): p. 152-6.
- Hidiroglou, M., et al., Possible roles of vitamin E in immune response of calves. Int J Vitam Nutr Res, 1992. 62(4): p. 308-11.
- Reddy, P.G., et al., Effect of supplemental vitamin E on the immune system of calves. J Dairy Sci, 1986. 69(1): p. 164-71.
- Reddy, P.G., et al., Vitamin E is immunostimulatory in calves. J Dairy Sci, 1987. 70(5): p. 993-9.
- Carter, J.N., et al., The effects of feeding vitamin E to sale barn-origin calves during the receiving period: animal performance and medical costs. 2000, Oklahoma State University. p. 70-75.
- Hogan, J.S., et al., Bovine neutrophil responses to parenteral vitamin E. J Dairy Sci, 1992. 75(2): p. 399-405.
- O’Rourke, D., Nutrition and udder health in dairy cows: a review. Irish Veterinary Journal, 2009. 62(Suppl 4): p. S15-S20.
- Lima, F.S., et al., Effects of feeding rumen-protected choline on incidence of diseases and reproduction of dairy cows. Vet J, 2012. 193(1): p. 140-5.
- Oldham, E.R., R.J. Eberhart, and L.D. Muller, Effects of supplemental vitamin A or beta-carotene during the dry period and early lactation on udder health. J Dairy Sci, 1991. 74(11): p. 3775-81.
- Weiss, W.P., J.S. Hogan, and K.L. Smith, Changes in vitamin C concentrations in plasma and milk from dairy cows after an intramammary infusion of Escherichia coli. J Dairy Sci, 2004. 87(1): p. 32-7.
- Chaiyotwittayakun, A., et al., The effect of ascorbic acid and L-histidine therapy on acute mammary inflammation in dairy cattle. J Dairy Sci, 2002. 85(1): p. 60-7.
- Naresh, R., et al., Evaluation of Ascorbic Acid Treatment in Clinical and Subclinical Mastitis of Indian Dairy Cows. Asian Australas. J. Anim. Sci, 2002. 15(6): p. 905-911.
- Politis, I., et al., Effects of vitamin E on immune function of dairy cows. Am J Vet Res, 1995. 56(2): p. 179-84.
- Politis, I., et al., Effects of vitamin E on mammary and blood leukocyte function, with emphasis on chemotaxis, in periparturient dairy cows. Am J Vet Res, 1996. 57(4): p. 468-71.
- Politis, I., Reevaluation of vitamin E supplementation of dairy cows: bioavailability, animal health and milk quality. Animal, 2012. 6(9): p. 1427-34.
- Politis, I., et al., Short communication: Oxidative status and incidence of mastitis relative to blood alpha-tocopherol concentrations in the postpartum period in dairy cows. J Dairy Sci, 2012.95(12): p. 7331-5.
- Allison, R.D. and R.A. Laven, Effect of vitamin E supplementation on the health and fertility of dairy cows: a review. Vet Rec, 2000. 147(25): p. 703-8.
- Smith, K.L., et al., Incidence of environmental mastitis as influenced by vitamin E and selenium. Kieler Milchow Forsch, 1984. 37: p. 482.
- Weiss, W.P., et al., Effect of vitamin E supplementation in diets with a low concentration of selenium on mammary gland health of dairy cows. J Dairy Sci, 1997. 80(8): p. 1728-37.
- Baldi, A., et al., Effects of vitamin E and different energy sources on vitamin E status, milk quality and reproduction in transition cows. J Vet Med A Physiol Pathol Clin Med, 2000. 47(10): p. 599-608.
- Bouwstra, R.J., et al., Vitamin E supplementation during the dry period in dairy cattle. Part I: adverse effect on incidence of mastitis postpartum in a double-blind randomized field trial. J Dairy Sci, 2010. 93(12): p. 5684-95.
- Bouwstra, R.J., et al., Vitamin E supplementation during the dry period in dairy cattle. Part II: oxidative stress following vitamin E supplementation may increase clinical mastitis incidence postpartum. J Dairy Sci, 2010. 93(12): p. 5696-706.
- Erskine, R.J., et al., Effects of parenteral administration of vitamin E on health of periparturient dairy cows. J Am Vet Med Assoc, 1997. 211(4): p. 466-9.
- Bergsten, C., et al., Effects of biotin supplementation on performance and claw lesions on a commercial dairy farm. J Dairy Sci, 2003. 86(12): p. 3953-62.
- Flachowsky, G., et al., The influence of oral niacin doses during different dietary protein levels on indexes of rumen fermentation, blood parameters and fattening performance of young bulls.Arch Tierernahr, 1993. 45(2): p. 111-29.
- Ikeda, S., et al., The roles of vitamin A for cytoplasmic maturation of bovine oocytes. J Reprod Dev, 2005. 51(1): p. 23-35.
- Tharnish, T.A. and L.L. Larson, Vitamin A supplementation of Holsteins at high concentrations: progesterone and reproductive responses. J Dairy Sci, 1992. 75(9): p. 2375-81.
- Meacham, T.N., et al., Effect of supplemental vitamin A on the performance of beef cows and their calves. J Anim Sci, 1970. 31(2): p. 428-33.
- Duplessis, M., et al., Effects of folic acid and vitamin B12 supplementation on culling rate, diseases, and reproduction in commercial dairy herds. J Dairy Sci, 2014. 97(4): p. 2346-54.
- Mosdol, G. and A.H. Skeie, The prophylactic use of vitamin D3 in parturient paresis in the cow in a practice district in eastern Norway. A retrospective investigation. Nord Vet Med, 1978. 30(2): p. 83-9.
- Horn, M., et al., Effects of natural (RRR alpha-tocopherol acetate) or synthetic (all-rac alpha-tocopherol acetate) vitamin E supplementation on reproductive efficiency in beef cows. J Anim Sci, 2010. 88(9): p. 3121-7.
- Bourne, N., et al., A meta-analysis of the effects of Vitamin E supplementation on the incidence of retained foetal membranes in dairy cows. Theriogenology, 2007. 67(3): p. 494-501.
- LeBlanc, S.J., et al., The effect of prepartum injection of vitamin E on health in transition dairy cows. J Dairy Sci, 2002. 85(6): p. 1416-26.
- LeBlanc, S.J., et al., Peripartum serum vitamin E, retinol, and beta-carotene in dairy cattle and their associations with disease. J Dairy Sci, 2004. 87(3): p. 609-19.
- Campbell, M.H. and J.K. Miller, Effect of supplemental dietary vitamin E and zinc on reproductive performance of dairy cows and heifers fed excess iron. J Dairy Sci, 1998. 81(10): p. 2693-9.