Worminfecties komen veel voor bij varkens. Ascariosis is de bekendste parasitaire aandoening en in dit artikel wordt een overzicht gegeven van de verschillende aspecten van de aandoening.
Welke wormen zijn bij varkens belangrijk?
Alhoewel er bij varkens infecties met meerdere wormsoorten worden beschreven, is het belang van infecties met Ascaris suum het grootst. Naast deze bekende rondworm komen op varkensbedrijven in Europa infecties voor met o.a. Oesophagostomum spp, Trichuris suis en Metastrongylus spp. Het belang hiervan wordt echter beduidend minder groot geacht. In onderstaande tabel staat een overzicht van de bekendste worminfecties bij varkens.
| Naam |
Indeling |
Belang in Nederland |
| Ascaris suum, spoelworm |
Nematode |
Groot, zoönose |
| Oesophagostomum spp, knobbelworm |
Nematode |
Gering |
| Trichuris suis, zweepworm |
Nematode |
Gering (zoönose?) |
| Metastrongylus spp, longworm |
Nematode |
Gering, enkel bedrijven met buitenloop (regenworm als tussengastheer) |
| Strongyloides ransomi, aaltjesworm |
Nematode |
Gering |
| Trichinella spiralis |
Nematode |
Gering, zoönose |
| Taenia solium, varkenslintworm |
Cestode |
Gering, zoönose |
Tabel 1: overzicht belangrijkste worminfecties bij varkens
Ascariosis
Ascariosis is één van de bekendste ziekten die bij varkens voorkomt. Toch hebben varkenshouders en dierenartsen niet altijd even veel aandacht voor deze ziekte. De reden hiervoor is dat de infectie meestal maar weinig klinische symptomen bij de varkens laat zien. Een andere reden kan zijn dat door verbeterde biosecurity en de brede kennis over de ziekte (behandeling en preventie) het belang op sommige bedrijven minder groot is geworden of wordt geacht.
Toch zijn er nog steeds interessante ontwikkelingen wat betreft de ziekte. Door toename van bedrijven met strobedding en buitenuitloop zal de prevalentie van de parasiet ook toenemen. Daarnaast zorgen nieuwe inzichten in de immunologische processen na A. suum infecties voor meer aandacht voor de ziekte. Ook het feit dat A. suum nu als een zoönose wordt gezien en de gelijkenis met humane A. lumbricoides infecties levert recente wetenschappelijke publicaties op. Verder is er aandacht voor genetische resistentie van varkens voor A. suum infecties. Mogelijk biedt dit in de toekomst kansen voor de fokkerij.
Prevalentie en economische betekenis
Verschillende Europese wetenschappelijke studies tonen een prevalentie aan van 11 – 88% geïnfecteerde varkensbedrijven en 4 – 36% geïnfecteerde varkens per bedrijf. De meeste van deze prevalentiestudies zijn op basis van eitellingen in faeces. Dit kan een onderschatting van het werkelijke voorkomen veroorzaken. Hierop wordt later ingegaan bij het hoofdstuk Diagnose.
Op veel varkensbedrijven zal een infectie met A. suum subklinisch verlopen. Indien er wel verschijnselen optreden kan er vooral hoest opgemerkt worden. De belangrijkste redenen voor het ontstaan van economische schade door A. suum infecties zijn echter een verhoogde voederconversie, een lagere groei, het afkeuren van levers en de kosten voor medicatie. In enkele Europese onderzoeken wordt een economische schade berekend van €1,15 – €4,61 per varken. Bijkomende indirecte gevolgen zijn onder andere een verhoogde kans op secundaire bacteriële infecties van de longen en een negatief effect op Mycoplasma hyopneumnoniae vaccinatie.
Epidemiologie
A. suum heeft een directe levenscyclus wat betekent dat er geen tussengastheer noodzakelijk is. Deze worm komt bijna uitsluitend voor bij varkens. Bij enkele andere diersoorten zoals het rund, het paard en de mens kunnen larven migreren tot in de longen waar ze meestal zullen sterven. Klinische verschijnselen, zoals respiratoire symptomen, kunnen hierbij optreden.
De volwassen wormen leven ter hoogte van de dunne darmen. Indien er zowel vrouwelijke als mannelijke volwassen wormen aanwezig zijn kunnen er dagelijks honderdduizenden eitjes door de vrouwelijke wormen geproduceerd worden. Deze eitjes komen met de mest in de omgeving terecht. De piek van de eiproductie wordt op ongeveer 14 weken na infectie bereikt. De ongeëmbryoneerde eitjes die in de omgeving terecht zijn gekomen ontwikkelen zich traag tot infectieuze eitjes met de L3-larve; dit duurt afhankelijk van de omstandigheden twee tot tien weken. De overlevingsduur van de infectieuze eitjes kan in stallen langer dan één jaar zijn. Buiten kunnen eitjes zelfs langer dan 6 jaar overleven. Ondanks dat er buiten ook veel eitjes afsterven kan er hierdoor toch accumulatie optreden.
Na opname van de infectieuze eitjes komen de L3 larven vrij in het darmlumen. De larven dringen de submucosa van het caecum en proximale colon binnen en bereiken vervolgens de lever via de vena porta. Na drie dagen heeft de meerderheid van de vrijgekomen larven de lever bereikt waarna er migratie naar de longen optreedt via de vena cava, het rechter hart en de arteria pulmonalis. De meeste L3 larven hebben de longen bereikt na zeven dagen. Door het ophoesten van de larven bevinden zij zich na tien dagen weer in de dunne darmen waar ze vervolgens vervellen tot L4 larven en immature L5 wormen. De meeste van deze L4 en L5 stadia zijn echter 17-21 dagen na de infectie al weer uit de darmen verdwenen door de normale peristaltiek en vermoedelijk ook door invloed van de opgebouwde immuniteit door het varken.
De L4 en L5 stadia zijn veel kleiner dan oudere volwassen wormen waardoor deze meestal niet worden opgemerkt in de mest. Slechts enkele larven zullen het volwassen stadium bereiken. Bij jonge varkens kunnen de volwassen wormen ongeveer 35 dagen post-infectie zelf eitjes produceren (prepatent periode). Bij oudere varkens is dit ongeveer 60 dagen. De volwassen wormen kunnen tot meer dan een jaar overleven in het varken. Bovenstaande levenscyclus geeft aan dat biggen die in het kraamhok geïnfecteerd zijn al vrij snel na het spenen eitjes kunnen uitscheiden.
De gehele cyclus van A. suum wordt weergegeven in Figuur 1.
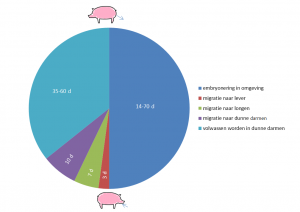
Figuur 1 Epidemiologie van A. suum infecties
Pathogenese en letsels
De gastheerafweer speelt een belangrijke rol in de pathogenese. Het zijn vooral de migrerende larven die de schade in het varken veroorzaken. Tijdens het migratieproces door de lever ontstaan er lokale ontstekingsprocessen van het granulatieweefseltype (white spots) of van het lymfonodulaire type. Bij lichte en primaire infecties ontstaan vooral kleine white spots. Het herstel van deze necrose letsels begint al na enkele dagen en na een maand zijn deze letsels verdwenen. Bij zware of secundaire infecties is er een verhoogde cellulaire immuunreactie wat grote white spots veroorzaakt. Deze worden pas na ongeveer tien dagen kleiner en volledig herstel is er pas na twee maanden. Deze verhoogde cellulaire reactie veroorzaakt een tragere migratie van de larven en verklaart de langere pre-patent periode bij oudere varkens. Letsels van het lymfonodulaire type worden minder vaak gezien en bestaan uit afgestorven larven omgeven door lymfocyten.
Bovengenoemde leverschade is voor de gezondheid van het varken niet van zeer groot belang. Dit kan wel het geval zijn bij de migratie door de longen. De larven veroorzaken kleine bloedingen op het moment dat ze de longbloedvaten verlaten. De larven kunnen vervolgens alveolair oedeem, bronchiolitis en interstitiële pneumonie veroorzaken.
Teruggekomen in de darmen veroorzaken de larven en wormen een catarrhale enteritis met geringe verterings- en resorptieverstoringen. De volwassen wormen in de darm voeden zich met de door het varken opgenomen nutriënten. Daarnaast vermindert de absorptie van voedingsstoffen door schade aan de darmvilli. Meer uitzonderlijk kunnen volwassen worden de galgang bereiken en daar obstructie veroorzaken. Darmobstructies met perforatie en peritonitis zijn zeer zeldzaam.

Figuur 3 – Pathologisch beeld bij ascariosis
Immuniteit
Varkens bouwen na herhaaldelijke infecties een sterke immuniteit op tegen nieuwe infecties. Vooral de L3 larven zijn belangrijk voor het opwekken van deze immuniteit. L4 larven en volwassen wormen zijn waarschijnlijk veel minder belangrijk in de opbouw van afweer. De immuniteit die opgebouwd wordt is specifiek van aard en eosinofielen spelen hierin een belangrijke rol.
In alle organen waarin A. suum zich bevindt wordt immuniteit opgebouwd maar het caecum en het proximale colon spelen hierin de belangrijkste rol. Hier wordt na langdurige blootstelling een “pre-hepatische barrière” gevormd. Naast eosinofielen spelen ook mastcellen en Globlet cellen een belangrijke rol in deze barrière. Th2-cellen zijn van belang bij het doden van A. suum en de productie van deze afweercellen wordt bij een A. suum infectie gestimuleerd. Daarentegen is er een downregulatie van Th1-cellen. Dit zou de vergrote kans op secundaire bacteriële en virale infecties en een negatief effect op de antistofproductie na vaccinatie kunnen verklaren. Naast deze afweercellen spelen ook verschillende cytokinen (o.a. IL-5 en IL-13), complementfactoren en specifieke antistoffen (IgG en IgE) een rol bij het doden van A. suum.
Diagnose
Aangezien er weinig symptomen optreden bij A. suum infecties ligt een klinische diagnose niet voor de hand. Na een behandeling met een anthelminthicum worden bij geïnfecteerde dieren wel vaak volwassen wormen in de mest ontdekt. Uitgescheiden onvolwassen wormen (L5) zijn veel moeilijker te ontdekken.
Het aantal eitjes dat uitgescheiden wordt met de mest geeft een indruk van de mate van infectie door A. suum. Het aantal eitjes is namelijk gecorreleerd met het aantal aanwezige volwassen wormen. Het aantal eitjes teruggevonden in de mest is echter niet gecorreleerd met de hoeveelheid migrerende larven.
Voor het aantonen van Ascaris eitjes in de mest wordt vaak de kwantitatieve McMaster methode gebruikt. Het resultaat wordt weergegeven als het aantal eitjes per gram feaces (EPG). Deze methode is gemakkelijk maar wel erg tijdrovend. Een nadeel van de test is dat enkel de aanwezigheid van volwassen wormen wordt aangetoond terwijl juist de migrerende larven de meeste schade veroorzaken. Ook de aanwezigheid van zowel mannelijke als vrouwelijke volwassen wormen in het darmlumen is een voorwaarde voor een positieve test. Een ander nadeel van de test is dat er mest van veel varkens onderzocht moeten worden omdat vaak slechts enkele varkens volwassen wormen bij zich dragen terwijl de meeste dieren weinig of geen volwassen wormen hebben. Ook worden eitjes vaak intermitterend uitgescheiden waardoor er vals negatieve resultaten kunnen worden verkregen. Vals positieve resultaten kunnen verkregen worden door coprofagie.
Sinds enkele jaren is er voor de diagnose van ascariosis een serologische test beschikbaar. Deze ELISA is gebaseerd op het haemoglobine van A. suum. Voor het aantonen van antistoffen via deze test is het niet noodzakelijk dat er volwassen wormen in het darmlumen aanwezig zijn; ook de migrerende L3 larven veroorzaken al een positieve test. Uit experimenteel onderzoek blijkt dat deze test een sensitiviteit van 99,5% en een specificiteit van 100% heeft. In dit onderzoek had het mestonderzoek een sensitiviteit van 59,5% en een specificiteit van 68,4%. De snelheid van seroconversie is afhankelijk van het aantal opgenomen infectieuze eitjes. De test kan al vier weken na infectie positief zijn maar het wordt aangeraden om vleesvarkens op het einde van de mestperiode te bemonsteren om een betrouwbaar beeld van de infectiedruk te krijgen.
Ook in het slachthuis kan er een indruk worden verkregen van de infectiedruk bij een koppel varkens. Vooral het controleren op de aanwezigheid van white spots op de levers is hierbij van belang. White spots zijn het gevolg van migrerende L3 larven en het aantal hiervan is dus relevant voor de schade die de varkens hebben opgelopen door de infectie. Een nadeel van deze methode is dat de white spots enkel een recente infectie aantonen. Herstel van de white spots duurt één tot twee maanden. Op bedrijven waar de varkens continu worden blootgesteld aan infectieuze eitjes neemt het aantal white spots toe tot 6-9 weken. Daarna worden er steeds minder white pots op de lever opgemerkt. Dit is gevolg van de opgebouwde immuniteit in het caecum en het proximale colon wat de migratie van de L3 larven van de darm naar de lever verhindert (pre-hepatische barrière).
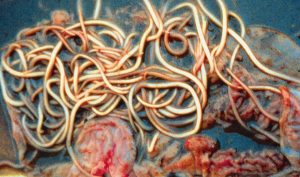
Figuur 2 Volwassen Ascaris suum wormen
Preventie
Preventie van ascariosis op varkensbedrijven is moeilijk. Vooral de productie van grote aantallen eitjes door de volwassen wormen en de lange levensduur van de infectieuze eitjes in de omgeving zijn hier debet aan. Reiniging met hoge druk en stoom in combinatie met enkele dagen leegstand is effectief om afdelingen schoon te krijgen maar is praktisch moeilijk uitvoerbaar. Sinds enige jaren is er ook aandacht voor schimmels die infectieuze eitjes zouden kunnen doden. Onderzoek naar genetische resistentie van varkens en effecten van voercomponenten op infecties hebben nog niet tot oplossingen geleid. Ook zijn er tot op heden nog geen vaccins tegen ascariosis beschikbaar.
Behandeling
Behandeling van worminfecties op varkensbedrijven gebeurt vaak door strategische inzet van anthelminthica. De behandelschema’s kunnen meer of minder intensief zijn. Een intensief schema op een gesloten bedrijf kan bestaan uit het ontwormen van (jonge) zeugen voordat ze in het kraamhok komen, gespeende biggen op zes weken leeftijd en vleesvarkens bij opleg en vervolgens elke vijf tot zes weken. Zelfs op bedrijven waar een intensief ontwormingsschema wordt ingezet kan het lang (een jaar) duren voordat het percentage afgekeurde levers in het slachthuis gaat dalen.
Hieronder worden de kenmerken van enkele veel gebruikte werkzame stoffen beschreven.
Benzimidazolen (o.a. flubendazol en fenbendazol)
Benzimidazolen hebben zowel een breed spectrum (naast werkzaamheid tegen nematoden ook vaak werkzaam tegen trematoden en cestoden) als een brede veiligheidsmarge voor het varken. De werking berust op de binding aan het nematode tubuline waardoor er een onvolledige polymerisatie ontstaat. De microtubuli zijn verantwoordelijk voor het intracellulair transport van voedingsstoffen in de lichaamscellen van de worm. Doordat deze microtubuli niet meer functioneel zijn ontstaat er degeneratie van darm- en integumentcellen van de worm, waarna de worm uiteindelijk sterft. Daarnaast berust de werking op het remmen van het energiemetabolisme door remming van het fumaraatreductase in de mitochondria. Benzimidazolen zijn werkzaam tegen wormeitjes, larven en volwassen wormen. De werking van benzimidazolen wordt als tijdsafhankelijk gezien.
Een nadeel van de benzimidazolen is dat ze zeer slecht wateroplosbaar zijn. Dit is van belang voor de biologische beschikbaarheid maar ook voor de praktische toepassing.
Resistentie tegen benzimidazolen kan ontstaan door modificatie van het tubuline van de worm waardoor de binding verhinderd wordt.
Imidazolthiazolen (o.a. levamisol)
Levamisol heeft een breed werkingsspectrum maar een smallere veiligheidsmarge. Levamisol stimuleert de sympathische en parasympatische ganglia in de wormen. De interactie met de cholinerge receptoren veroorzaakt een depolarisatie en een spastische paralyse. Hierdoor worden de wormen vaak levend uitgescheiden. In hogere concentraties interfereert levamisol met het koolhydraatmetabolisme van de worm door remming van het fumaraatreductase.
Behalve als ontwormingsmiddel wordt levamisol ook gebruikt als modulator van het immuunsysteem. Levamisol wordt dan toegepast in 1/3 tot 1/4 van de normale therapeutische dosering gedurende meerdere dagen. Dit gebruik van levamisol stimuleert de activiteit van T-lymfocyten en fagocyterende monocyten. In verschillende experimenten werd er een hogere antistoftiter verkregen na vaccinatie. De immuunstimulerende werking wordt vooral gezien in dieren met een onderdrukt immuunsysteem. Overdosering van levamisol geeft eerder aanleiding tot immunosuppressie.
Een groot voordeel van levamisol is de goede wateroplosbaarheid.
Macrocyclische lactonen (o.a. ivermectine)
Ivermectine heeft een breed werkingsspectrum en een brede veiligheidsmarge (behalve voor enkele hondenrassen, verschillende vogelsoorten, schildpadden en vissen). Ivermectine stimuleert de uitstorting van de inhibitorische neurotransmittoren GABA en glutamaat. Hierdoor wordt de rustpotentiaal versterkt en wordt de post-synaptische stimulatie van het aangrenzende neuron geblokkeerd. Dit resulteert in verlamming van de worm. Verder heeft ivermectine invloed op het reproductieproces van de parasiet.
GABA en glutamaat receptoren bevinden zich ook in het centraal zenuwstelsel van zoogdieren. Ivermectine passeert echter niet de bloed-hersenbarrière.
Ivermectine is zeer lipofiel wat resulteert in een lage biologische beschikbaarheid na orale opname. Na injectie is de absorptie bijna volledig. Ivermectine heeft een uitgebreide weefseldistributie. Door opslag in het vetweefsel hebben de macrocyclische lactonen een persisterende werking van twee tot zes weken.
Tabel 2: overzicht enkele anthelminithica
|
Spectrum |
Veiligheidsmarge |
Werking |
Wateroplosbaarheid |
Opmerkingen |
Flubendazol
Fenbendazol |
Breed |
Breed |
Afdoding worm |
Slecht |
Tijdsafhankelijk |
| Levamisol |
Breed |
Smal |
Spastische paralyse |
Goed |
In lage dosering immunostimulerend |
| Ivermectine |
Breed |
Breed |
Paralyse |
Slecht |
Ook werkzaam tegen ectoparasieten |
Referenties
- Vercruysse J. Parasitaire ziekten bij huisdieren. Deel 4 Het varken. Merelbeke: Vercruysse J; 1999
- Roepstorff A, Mejer H, Nejsum P, Thamsborg SM. Helminth parasites in pigs: New challenges in pig production and current research highlights. Veterinary Parasitology 2011;180:72-81
- Roepstorff A and Jorsal SE. Prevalence of helminth infections in swine in Denmark. Veterinary Parasitology 1989;33(304):231-239
- Roepstorff A, Nilsson O, O’Callaghan CJ, Oksanen A, Gjerde B, Richter SH, Ortsenberg EÖ, Christensson D, Nansen P, Eriksen L, Medley GF. Intestinal parasites in swine in the Nordic countries: multilevel modeling of Ascaris suum infections in relation to production factors. Parasitology 1999;119(5):521-534
- Eijck I en Borgsteede FHM. A survey of gastrointestinal pig parasites on free-range, organic and conventional pig farms in the Netherlands. Veterinary Research Communications 2005;29:407-414
- Haugegaard J. Prevalence of nematodes in Danish industrialised sow farms with loose housed sows in dynamic groups. Veterinary Parasitology 2010;168(1-2):156-159
- Vercruysse J. Study of the prevalence of white spots of the liver in pigs in Belgium and its relationship to management practices and anthelmintic treatment. Vlaams Diergeneeskundig Tijdschrift 1997;66:28-30
- Sanchez-Vazquez MJ, Nielen M, Gunn GJ, Lewis FI. National monitoring of Ascaris suum related liver pathologies in English abattoirs; a time-series analysis, 2005-2010. Veterinary Parasitology 2012;184(1):83-87
- Van Meensel J, Kanora A, Lauwers L, Jourquin J, Goossens L, Van Huylenbroeck G. From research to farm: ex ante evaluation of strategic deworming in pig finishing. Veterinari Medicina 2010;55(10):483-493 2010
- Steenhard NR, Jungersen B, Kokotovic B, Beshah E, Dawson HD, Urban Jr JF, Roepstrorf A, Thamsborg SM. Ascaris suum infection negatively affects the response to a Mycoplasma hyopneumoniae vaccination and subsequent infection in pigs. Vaccine 2009;27(37):5161-5169
- Fagerholm HP, Nansen P, Roepstorff A, Frandsen F, Eriksen L. Differentiation of cuticular structures during the growth of the third-stage larva of Ascaris suum (nematoda, ascaridoidea) after emerging from the egg. Parasitology 2000;86(3):421-427
- Roefstorff A, Eriksen L, Slotved HC, Nansen P. Experimental Ascaris suum infection in the pig: worm population kinetics following single inoculations with three doses of infective eggs. Parasitology 1997;115:443-452
- Jungersen G, Eriksen L, Roepstorff A, Lind P, Meeusen ENT, Rasmussen T, Nansen P. Experimental Ascaris suum infection in the pig: protoective memory response after three immunizations and effect of intestinal adult worm population. Parasite Immunolgy 1999;21:619-630
- Masure D, Vlaminck J, Wang T, Chiers K, Broeck van den W, Vercruysse J, Geldhof P. A role for eosinophils in the intestinal immunity against infective Ascaris suum larvae. PLoS Neglected Tropical Diseases 2013;7(3):e2138. Doi:10.1371/journal.pntd.0002138
- Eriksen L, Nansen P, Roepstorff A, Lind P, Nilsson O. Response to repeated inoculations with Ascaris suum eggs in pigs during the fattening period. I. Studies on worm fattening kinetics. Parasitology Research 1992;78(3):241-246
- Vlaminck J, Nejsum P, Vangroenweghe F, Thamsborg SM, Vercruysse J, Geldhof P. Evaluation of a serodiagnostic test using Ascaris suum haemoglobin fort he detection of roudworm infections in pig populations. Veterinary Parasitology 2012;189:267-273
- De Backer P. Algemene farmacologie. Deel III. Merelbeke: De Backer P; 1999
- Plumb DC. Plumb’s Veterinary Drug Handbook. 7th edition. Stockholm, Wisconsin: PharmaVet Inc.; 2011