Parasitaire aandoeningen zijn economisch en klinisch relevante ziekten. In dit artikel wordt gesproken over de etiologie, verschijnselen, diagnostiek, therapie en behandeling van zowel coccidiose als cryptosporidiose bij kalveren.
Coccidiose
Etiologie
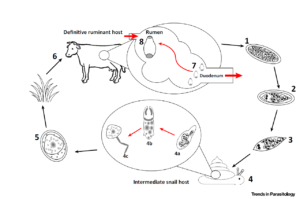
Coccidiose wordt veroorzaakt door Eimeria spp, waarvan E. bovis en E. zuernii als meest pathogeen worden gezien [1]. E. alabamensis is echter ook gerelateerd aan ernstige diarree [2]. In Nederland is dit zelfs de meeste voorkomende Eimeria species [3].
Kalveren die geïnfecteerd zijn scheiden veel oöcysten uit [2]. Daarnaast scheiden volwassen dragers ook oöcysten uit [4]. Deze zijn na enkele dagen infectieus en kunnen langer dan een jaar infectieus blijven [2]. De oöcysten overleven vooral in een vochtige omgeving zonder direct zonlicht [4]. De GD schat dat coccidiose in Nederland op vrijwel alle bedrijven voorkomt [2]. Mestonderzoek uitgevoerd in Nederland (2007-2011) liet zien dat coccidiose op 67% van de bedrijven en in 62% van de monsters voorkomt. Gedurende deze periode steeg de incidentie van E. alabamensis van 38% naar 58% en nam de incidentie van E. bovis af van 53% naar 38%. De incidentie van E. zuernii bleef met 5% ongeveer gelijk [5].In 47% van de infecties gaat het om een menginfectie met verschillende Eimeria spp, waarbij E. alabamensis in 95% van de gevallen voorkomt [3, 5].
De prepatentperiode varieert per Eimeria species; E. bovis heeft een prepatentperiode van 17 dagen, E. zuernii van 18 dagen en E. alabamensis van slechts 8 dagen [4].
Er zijn tal van predisponerende factoren die een rol spelen bij optreden van problemen door coccidiose. Doorgaans gaat het om een combinatie van een hoge infectiedruk en een lage afweer van de kalveren. Belangrijke factoren zijn:
- Huisvesting: het samenbrengen van dieren vanaf verschillende locaties. Kalveren worden bij voorkeur individueel gehuisvest tot drie weken leeftijd, daarna in kleine stabiele groepen via een all-in-all-out systeem. Overbevolking moet worden voorkomen;
- Voeding: abrupte voerovergangen en het spenen van de kalveren;
- Dagelijks management: met name een slechte hygiëne, vooral het niet goed schoonmaken van de waterbakken is speelt een rol. Ook transport kan een risicofactor zijn [4, 6, 7].
Verschijnselen
Verschijnselen worden gezien bij kalveren en jongvee [2], vooral op de leeftijd van drie weken tot zes maanden [8]. Een enkele keer worden verschijnselen gevonden bij volwassen dieren [9]. Coccidiose gaat voornamelijk gepaard met diarree, soms met bloed en slijm. Daarnaast kunnen een daling van de eetlust en anemie optreden [1, 2]. De sterfte is 2 – 10%, afhankelijk van de leeftijd waarop de kalveren geïnfecteerd raken [2]. Er is een verschil in verschijnselen tussen de verschillende Eimeria species. E. bovis en E. zuernii vermeerderen in het colon en een infectie leidt tot bloedbijmenging in de mest en persen op de mest. E. alabamensis vermeerdert in de dunne darm en veroorzaakt vooral een waterige diarree [3].
De economische schade wordt vooral veroorzaakt door kalveren die subklinisch geïnfecteerd raken en achterblijven in groei [2, 8]. Er zijn ook langetermijneffecten, zoals op de vruchtbaarheid; kalveren die een metafylactische behandeling kregen, werden eerder geïnsemineerd en hadden een hoger drachtigheidspercentage bij de eerste inseminatie dan controledieren die een infectie doormaakten [8].
Diagnostiek
Ter bevestiging van de diagnose kan mestonderzoek worden gedaan. De uitscheiding van oöcysten varieert echter sterk tussen dieren. De GD adviseert daarom mengmonsters van vijf dieren in te sturen [2]. Mestonderzoek wordt gedaan met de Mc Master flotatietechniek met een verzadigde zoutoplossing. De verschillende Eimeria species worden gedifferentieerd op basis van morfologische kenmerken [5].
Preventie
Desinfectiemiddelen werken vaak niet tegen oöcysten. Heet water (> 60˚C) en oplossingen met een hoge concentratie ammoniak of azijnzuur zijn wel effectief [2]. Ook formaldehyde kan gebruikt worden. Reiniging met deze producten is echter lastig omdat er beschermende maatregelen nodig zijn voor de persoon die het uitvoert en omdat de dieren niet in de stal kunnen blijven tijdens de reiniging [5]. Andere preventieve maatregelen berusten vooral op het voorkomen van orale opname van mest. Hiervoor is hygiëne belangrijk. Daarnaast moet worden voorkomen dat kalveren het voer in de stal kunnen trekken, waar het bezoedeld kan raken. Tot slot is er een verband met ligruimte; bij minder dan 1,5 m2 per kalf neemt de kans op coccidiose toe [2]. Deze maatregelen gelden vooral voor E. bovis en E. zuernii. Bij E. alabamensis vindt een infectie vaak plaats via hooi afkomstig van besmette percelen [10].
Therapie
Coccidiose kan behandeld worden met producten met sulfonamiden, diclazuril of toltrazuril [11]. Zowel diclazuril als toltrazuril zorgt voor een daling van het aantal oöcysten en het voorkómen van diarree. Bij het gebruik van diclazuril steeg het aantal oöcysten in de mest echter wel sneller dan bij het gebruik van toltrazuril [12]. In twee andere studies werd juist aangetoond dat met een behandeling met diclazuril op de lange termijn betere resultaten werden behaald [13, 14].
Een metafylactische behandeling wordt meestal gedurende de prepatentperiode gegeven [4, 11], omdat dit het moment is waarop schade optreedt. De prepatentperiode bestaat uit twee aseksuele cycli en één seksuele cyclus. De schade vindt doorgaans plaats tijdens de seksuele cyclus. Bij een hoge infectiedruk vindt deze zowel tijdens de seksuele als de tweede aseksuele cyclus plaats [5]. Bij infecties met E. bovis en E. zuernii vindt een behandeling twee weken na een risicoperiode (zoals spenen) of een week voordat problemen worden verwacht plaats [4, 11]. Voor E. alabamensis is het geïndiceerd drie dagen na de risicoperiode te behandelen [5]. Het is belangrijk dat de dieren in aanraking komen met oöcysten, zodat ze immuniteit kunnen opbouwen. Als dit niet voldoende gebeurt, kan een tweede behandeling nodig zijn [11].
In Nederland zijn alleen producten met toltrazuril geregistreerd met als indicatie de behandeling van E. bovis en E. zuernii.
Cryptosporidiose
Etiologie
Cryptosporidiose wordt veroorzaakt door Cryptosporidium spp. De meest voorkomende species is C. parvum. Andere voorkomende species zijn C. bovis en C. andersoni [15-17]. C. parvum komt vooral voor bij dieren jonger dan twee maanden. C. bovis wordt meestal gevonden bij pinken en C. andersoni bij volwassen runderen [17-19]. Dieren kunnen ook achtereenvolgens door verschillende species worden geïnfecteerd [19]. Klinische verschijnselen door cryptosporidiose komen meestal voor op de leeftijd van 3 – 45 dagen, specifiek op dag 5 – 15 [20-22].
Cryptosporidiën zijn in 60% van de diarreegevallen de (mede)oorzaak hiervan [20, 21]. In de UK is zelfs beschreven dat het de belangrijkste darmaandoening is bij kalveren tot één maand oud [23].
Kalveren kunnen geïnfecteerd raken via volwassen dragers, bijvoorbeeld kort na de partus [23]. De uitscheiding van oöcysten door koeien steeg namelijk in de periode rond afkalven [22, 24]. Oöcysten werden bij kalveren al na vijf dagen gevonden, wat overeenkomt met de prepatentperiode van 5 – 12 dagen [22]. In deze studie werden echter geen C. parvum oöcysten bij melkvee gevonden [24]. Overdracht van oöcysten tussen kalveren is ook zeer waarschijnlijk. Indirecte overdracht via water of stof kan ook optreden [22, 23]. Oöcysten zijn aangetoond in stof afkomstig van vensterbanken en balken in de stal. De oöcysten zijn hier waarschijnlijk door vliegen naartoe getransporteerd [22].
Cryptosporidiose is een veel voorkomende aandoening waarvan de infectiedruk snel kan oplopen. Hier zijn meerdere redenen voor:
- De korte prepatentperiode [20, 25];
- De uitscheiding van grote aantallen oöcysten door geïnfecteerde dieren (100 tot 170.000 oöcysten per gram faeces) [23, 26], terwijl slechts een klein aantal oöcysten nodig is om een kalf te infecteren (50 oöcysten) [27];
- Het feit dat de oöcysten direct na uitscheiding al infectieus zijn;
- De lange infectieuze periode van oöcysten;
- De ongevoeligheid van oöcysten voor standaard desinfectiemiddelen [20, 25].
Hoewel slechts een klein aantal oöcysten nodig is voor een infectie, wordt een hoger aantal oöcysten wel geassocieerd met een grotere kans op diarree [25, 26].
In onderstaande tabel worden studies weergegeven waarin de prevalentie van cryptosporidiose wordt beschreven.
| Land |
Jaar monstername |
Agens |
Prevalentie bedrijven |
Prevalentie dieren |
Ref |
| Duitsland |
20141 |
Cryptosporidium spp |
60,8% |
92,9% |
[28] |
| Zweden |
2012-2013 |
Cryptosporidium spp |
97% |
36,7% |
[29] |
| C. parvum |
– |
8% |
| Frankrijk |
2010-2012 |
Cryptosporidium spp |
– |
92-100% |
[27] |
| Nederland |
2007 |
C. parvum |
57% |
27,8% |
[30] |
| Roemenië |
2006-2011 |
Cryptosporidium spp |
– |
37,4% |
[31] |
| Spanje |
2006-2007 |
Cryptosporidium spp |
76,8% |
57,8% |
[32] |
| Noorwegen |
20061 |
Cryptosporidium spp |
53% |
12% |
[33] |
| Zweden |
2005-2007 |
C. parvum like |
96% |
52%2 |
[34] |
| België |
2001-2005 |
Cryptosporidium spp |
24-34%3 |
17-68% |
[35] |
| Italië |
2001-2003 |
C. parvum |
32,6%4 |
8% |
[36] |
| Spanje |
2000 |
C. parvum |
– |
47,9% |
[37] |
1 Jaar van publicatie; jaar van monstername niet bekend.
2 Prevalentie bij kalveren, bij jongvee is deze 29% en bij melkvee 5,6%.
3 Prevalentie van respectievelijk vleesvee- en melkveebedrijven. Dierprevalentie getest bij kalveren <4 weken.
4 Prevalentie van melkveebedrijven, prevalentie van zoogbedrijven is 3,1%.
Leeftijdsresistentie
Bij kalveren is de leeftijd waarop ze geïnfecteerd raken erg belangrijk. Kalveren die in de eerste levensweek geïnfecteerd raakten, kregen allemaal diarree en scheidden allemaal oöcysten uit, gedurende gemiddeld zes dagen. Als deze kalveren op de leeftijd van één of drie maanden opnieuw werden geïnfecteerd, scheidden ze geen oöcysten uit. Bij kalveren die op de leeftijd van één maand werden geïnfecteerd, ontstond hetzelfde beeld. Als de eerste infectie echter op drie maanden leeftijd optrad, werd slechts een deel van de dieren ziek. Ze scheidden wel allemaal oöcysten uit [38]. De productie van IgG in respons op een C. parvum infectie nam ook toe met de leeftijd tot drie maanden; daarna was er geen leeftijdsafhankelijke toename meer [39].
Zoönose
De bestrijding van cryptosporidiose is niet alleen van belang voor de gezondheid en goede productie van kalveren; cryptosporidiose is ook een zoönose [20]. Kalveren kunnen een infectiebron voor mensen zijn als het gaat om C. parvum infecties [35, 40-42]. Bij mensen komt echter voornamelijk C. hominisi voor, welke bij rundvee niet werd gevonden [42]. Daarnaast zijn er ook genetische verschillen tussen stammen geïsoleerd uit mensen en uit kalveren, wat erop duidt dat zeker een deel van de humane infecties niet zoönotisch is [43]. Drinkwater is een mogelijke manier van transmissie van dier op mens, omdat de oöcysten niet gevoelig zijn voor de normale methoden waarop het drinkwater gereinigd wordt [25, 26].
Risicofactoren
Er zijn tal van risicofactoren die van belang zijn bij het optreden van cryptosporidiose:
- Het kalf na de geboorte (langer) bij de koe laten [25, 26, 44]. Een andere studie liet echter juist zien dat de incidentie van cryptosporidiose op zoogbedrijven laag is, door de beschermende rol van antilichamen in de melk [36];
- Toediening van een slechte kwaliteit biest [44]. Biest wordt echter niet door alle auteurs als belangrijk bevonden, omdat de passieve immuniteit door IgG in de biest niet voldoende beschermend is [45].
- Seizoensinvloed. Kalveren die in de zomer worden geboren, hebben een grotere kans op het ontwikkelen van cryptosporidiose [25, 26, 44];
- Kalverhokken op een vaste plaats. Bedrijven waar hokken worden gebruikt die regelmatig worden verplaatst, hebben een lagere prevalentie [23];
- Het mengen van kalveren van verschillende leeftijden. Dit geldt vooral als kalveren van 1-3 weken leeftijd worden gemengd met neonaten [23, 45].
- Hygiëne. Zowel de manier waarop wordt schoongemaakt als de frequentie waarmee dit gebeurt, zijn van belang [37].
- Antibioticabehandeling. Op bedrijven waar diarree standaard wordt behandeld met antibiotica is de kans op uitscheiding van cryptosporidiose oöcysten 3,2 keer hoger dan op andere bedrijven [30].
- Het toedienen van ORS in plaats van melk of melkvervanger. Dit is gecorreleerd aan een grotere kans op het vinden van oöcysten in de mest [30].
Verschijnselen
Het belangrijkste verschijnsel is een waterige diarree, waarin slijm en bloed kunnen voorkomen. Andere mogelijke verschijnselen zijn sufheid, een slechte eetlust, gewichtsverlies en uitdroging. De mortaliteit is 2 – 10% [2, 4]. Verschijnselen zijn ernstiger wanneer C. parvum voorkomt in combinatie met andere pathogenen zoals corona- of rotavirus of E. coli [28], maar ook wanneer alleen Cryptosporidium voorkomt, kunnen er ernstige verschijnselen voorkomen [46]. Ook is het risico op het optreden van secundaire bacteriële infecties groter [4].
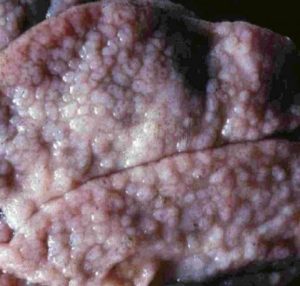
Bij pathologisch onderzoek worden oedemateuze en hyperemische veranderingen van de darmmucosa met bloedingen en soms lokale erosies gevonden. De mesenteriale lymfeknopen kunnen verdikt en hyperemisch zijn en ook hier kunnen bloedingen worden gevonden [47].
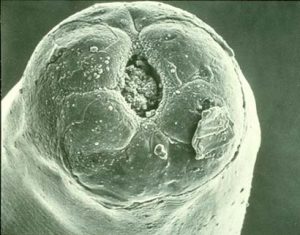
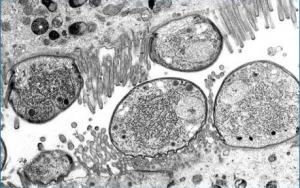
De darmcellen van de dunne darm zijn beschadigd door vermenigvuldiging van de cryptosporidiën. Het gevolg is kortere darmvilli en een verminderde absorptie van nutriënten, waaronder de absorptie van vitamine A [20, 48]. Daarnaast kunnen er met histologie grote aantallen neutrofielen in de darmmucosa gevonden worden [47].
Diagnostiek
De diagnose wordt bevestigd aan de hand van mestonderzoek. Het wordt aangeraden hiervoor mest rechtstreeks uit het rectum te nemen. Deze mest kan onderzocht worden op oöcysten. Wanneer er gekozen wordt voor microscopisch onderzoek heeft de suikerflotatietest de hoogste sensitiviteit en specificiteit [17, 49]. Het uitvoeren van een PCR is echter nauwkeuriger en hiermee kan ook een relatief laag aantal oöcysten worden aangetoond [49, 50]. Daarnaast kunnen de stammen met een PCR moleculair getypeerd worden [25].
Een enzym-immuno-assay-test kan uitgevoerd worden, ook op het lab van de praktijk. Deze test is nauwkeuriger dan microscopische beoordeling van de mest [51, 52].
In de praktijk kan gebruik worden gemaakt van een laterale-flowtest (immunochromatografie). Met deze sneltest wordt vaak niet alleen op cryptosporidiose getest, maar ook op andere darmpathogenen [53]. Dopharma heeft op aanvraag ook een test beschikbaar waarmee de mest getest kan worden op rotavirus, coronavirus, cryptosporidium, E.coli (K99) en E.coli CS31A.
Als de mest niet direct onderzocht kan worden, kan deze maximaal drie dagen gekoeld bewaard worden. Het monster gekoeld bewaren is vooral belangrijk bij microscopisch onderzoek of kleuringen, omdat het behoud van de morfologische eigenschappen dan van belang is [51].
Preventie
Belangrijke preventieve maatregelen zijn het geven van voldoende biest en het toepassen van een goede hygiëne, vooral van de hokken. Alleen ontsmettingsmiddelen met quaternaire ammoniumverbindingen of waterstofperoxide zijn effectief, mits in een juiste concentratie toegepast. Voor het beste resultaat worden de hokken enkele dagen leeg gelaten om te drogen [20, 23]. De besmettelijkheid van oöcysten kan significant verlaagd worden door de oöcysten gedurende enkele seconden bloot te stellen aan temperaturen > 70 ˚C of temperaturen < 0 ˚C [23, 26]. Omdat vliegen oöcysten kunnen verspreiden behoort ook vliegenbestrijding tot de preventieve maatregelen [26].
Er is geen vaccin beschikbaar tegen cryptosporidiose, maar hier is wel onderzoek naar gedaan. Hierbij werden positieve resultaten behaald [54, 55], mits het vaccin direct na de geboorte werd toegediend [55]. De bescherming was niet volledig, maar het vaccin zorgde wel voor een kortere duur van de diarree en een kortere duur van oöcystenuitscheiding. Hierdoor werd ook de infectiedruk in de omgeving verlaagd. Herhaling van de studie onder praktijkresultaten leverde geen goede resultaten op, waarschijnlijk omdat de infectiedruk zo hoog was dat de kalveren geen tijd hadden om een immuunreactie te ontwikkelen voordat ze werden blootgesteld aan hoge concentraties oöcysten [55].
Het vaccineren van de melkkoeien ter bescherming van de kalveren na de geboorte is niet effectief gebleken. Dit komt waarschijnlijk omdat Cryptosporidium spp een intracellulaire parasiet is, waarvoor de bescherming grotendeels afhangt van de cellulaire immuniteit [55].
Ook de toediening van bepaalde voedermiddelen is onderzocht. Het gebruik van een product met geactiveerde kool en azijn resulteerde in een daling van het aantal oöcysten en het voorkomen van klinische verschijnselen [56, 57]. Bij het gebruik van kurkuma daalde het aantal oöcysten, maar met slechts 27,8% [58]. Granaatappel kan ook een rol spelen bij het verlichten van de schade door Cryptosporidium [59].
Therapie
Het enige in Nederland geregistreerde product is gebaseerd op halofuginone lactaat. Dit is geregistreerd voor de preventie of reductie van diarree door Cryptosporidium parvum. Het product moet binnen 24 – 48 uur post partum of binnen 24 uur na het ontstaan van de diarree worden toegediend. Toediening aan dieren die reeds langer dan 24 uur diarree hebben of verzwakt zijn is gecontra-indiceerd [60]. Deze stof doodde de parasiet niet, maar zorgde wel voor een sterke daling van de infectiedruk en het uitstellen van de piek van oöcystenuitscheiding [20, 61-66]. Hoe hoger de toegepaste dosering, hoe langer de piek van oöcystenuitscheiding werd uitgesteld [61, 63]. Bij de toediening van halofuginone werd de diarree echter niet altijd voorkomen, maar uitgesteld en verminderd in ernst [45, 62, 65, 67]. Voor een optimaal resultaat moet de toediening van halofuginone gecombineerd worden met een goede hygiëne [45, 68]. Een behandeling met halofuginone interfereerde niet met de opbouw van immuniteit [61], mits de dosering niet te hoog was [66].
Naast halofuginone lactaat kan ook paromomycine gebruikt worden; dit molecuul leidde eveneens tot een daling van de ernst van de infectie en de uitscheiding van oöcysten bij kalveren [25, 67, 69]. In Nederland is echter geen paromomycine bevattend product geregistreerd voor deze indicatie.
Naast het geven van een specifieke therapie, wordt het ook aangeraden om de kalveren te behandelen met een NSAID zoals meloxicam of flunixine om het herstel te bevorderen [67]. Een eenmalige injectie met meloxicam bij kalveren met natuurlijk optredende diarree vergrootte de kans dat ze alle aangeboden melk consumeerden. Daarnaast startten ze eerder met ruwvoeropname en nam de groei toe [70, 71].
Dopharma heeft drie producten met meloxicam in het assortiment die geregistreerd zijn voor de behandeling van diarree, in combinatie met een orale rehydratietherapie. Meer informatie kunt u vinden op de productpagina’s:
Daarnaast heeft Dopharma een aanvullend dieetvoedermiddel in het assortiment dat gebruikt kan worden in het geval van risico op spijsverteringsstoornissen (diarree)”:
Referenties
- Bisen, S., et al., Diagnosis and treatment of bovine coccidiosis – A report of 16 cow calves. Intas Polivet, 2015. 16(1): p. 97-98.
- Holzhauer, M., Coccidiose geeft op veel bedrijven schade bij kalveren, in GD Herkauwer. 2012. p. 19.
- Holzhauer, M., Resultaten coccidiose onderzoek bij kalveren, in GD Veterinair. 2013, GD Animal Health. p. 3.
- Reynolds, M. Calf coccidiosis – Disease review and recent data. 2014 [cited 2016 Aug 2016].
- Vanholder, T., M. Holzhauer, and C. Müelenaere, de, Resultaten van vijf jaar mestonderzoek op coccidiose bij kalveren. Tijdschrift voor Diergeneeskunde, 2013. 138(11): p. 22-27.
- Leneman, M., Coccidiose, verklikker van het management, in Veehouder & Veearts. 2015. p. 9-10.
- Mitchell, E.S., R.P. Smith, and J. Ellis-Iversen, Husbandry risk factors associated with subclinical coccidiosis in young cattle [abstract]. Vet Journal, 2012. 193(1): p. 119-123.
- Borsberry, S. Coccidiosis in dairy heifers: long-term disease effects. 2014 [cited 2016 August 2016].
- Sudhakara Reddy, B., S. Sivajothi, and V.C. Rayulu, Clinical coccidiosis in adult cattle [Abstract]. J Parasit Dis, 2015. 39(3): p. 557-559.
- Holzhauer, M., Coccidiose op het rundveebedrijf, in GD Veterinair. 2014. p. 1.
- Taylor, M.A., et al., Role of immunity in the managament and control of bovine coccidiosis. Vet Rec, 2010. 166: p. 831-832.
- Alzieu, J.P., et al. Comparative long term efficacy of diclazuril and toltrazuril against natural infection by Eimeria bovis and Eimeria zuernii in calves. in European Buiatrics Forum. 2013. Marseille.
- Zechner, G., et al., Efficacy of diclazuril and toltrazuril in the prevention of coccidiosis in dairy calves under field conditions. Vet Rec, 2015. 176(5): p. 126.
- Philippe, P., et al., Comparative efficacy of diclazuril (Vecoxan(R)) and toltrazuril (Baycox bovis(R)) against natural infections of Eimeria bovis and Eimeria zuernii in French calves. Vet Parasitol, 2014. 206(3-4): p. 129-37.
- Imre, K. and G. darabus, Distribution of Cryptosporidium species, genotypes and C.parvum subtypes in European countries. Sci Parasitol, 2011. 12(1): p. 1-9.
- Rieux, A., et al., Molecular characterization of Cryptosporidium isolates from high-excreting young dairy calves in dairy cattle herds in Western France. Parasitol Res, 2013. 112(10): p. 3423-31.
- Rekha, K.M., G.C. Puttalakshmamma, and P.E. D’Souza, Comparison of different diagnostic techniques for the detection of cryptosporidiosis in bovines. Vet World, 2016. 9(2): p. 211-5.
- Rieux, A., et al. Molecular characterization of Cryptosporidium spp in cattle in western France. in European Buiatrics Forum. 2013.
- Follet, J., et al., Cryptosporidium infection in a veal calf cohort in France: molecular characterization of species in a longitudinal study. Vet Res, 2011. 42: p. 116.
- Meganck, V. Cryptosporidium parvum bij het kalf. [cited 2016 09-08-2016].
- Santin, M., J.M. Trout, and R. Fayer, A longitudinal study of cryptosporidiosis in dairy cattle from birth to 2 years of age. Vet Parasitol, 2008. 155(1-2): p. 15-23.
- Faubert, G.M. and Y. Litvinsky, Natural transmission of Cryptosporidium parvum between dams and calves on a dairy farm. J Parasitol, 2000. 86(3): p. 495-500.
- Hotchkiss, E., et al., Update on the roel of cryptosporidiosis in calf diarrhoea, in Livestock. 2015. p. 2-6.
- De Waele, V., et al., Peri-parturient rise of Cryptosporidium oocysts in cows: new insights provided by duplex quantitative real-time PCR. Vet Parasitol, 2012. 189(2-4): p. 366-8.
- Trotz-Williams, L.A., A.S. Peregrine, and K.E. Leslie, Cryptosporidiosis in diary calves: risk factors, diagnosis and zoonotic potential. Large Animal Veterinary Rounds, 2007. 7(4): p. 1-5.
- Peregrine, A.S., K.E. Leslie, and L.A. Trotz-Williams. Cryptosporidiosis in dairy calves. in OVMA Conference. 2005.
- Rieux, A., et al., Molecular characterization of Cryptosporidium isolates from beef calves under one month of age over three successive years in one herd in western France [Abstract]. Vet Parasitol, 2014. 202(3-4): p. 171-9.
- Göhring, F., et al., Co-infections with Cryptosporidium parvum and other enteropathogenes support the occurrence and severity of diarrhoea in suckling calves [Abstract]. Tierärztliche Umschau 2014. 69(4): p. 112-120.
- Bjorkman, C., et al., Cryptosporidium infections in suckler herd beef calves. Parasitology, 2015. 142(8): p. 1108-14.
- Bartels, C.J., et al., Prevalence, prediction and risk factors of enteropathogens in normal and non-normal faeces of young Dutch dairy calves. Prev Vet Med, 2010. 93(2-3): p. 162-9.
- Imre, M., et al. Risk factors associated with cryptosporidium infection in diarrheic pre-weaned calves. in 17th International Congress on Animal Hygiene 2015. Košice, Slovakia.
- Quilez, J., et al., Cryptosporidium species and subtype analysis from dairy calves in Spain [Abstract]. Parasitology, 2008. 135(14): p. 1613-20.
- Hamnes, I.S., B. Gjerde, and L. Robertson, Prevalence of Giardia and Cryptosporidium in dairy calves in three areas of Norway [Abstract]. Vet Parasitol, 2006. 140(3-4): p. 204-16.
- Silverlas, C., et al., Prevalence and associated management factors of Cryptosporidium shedding in 50 Swedish dairy herds [Abstract]. Prev Vet Med, 2009. 90(3-4): p. 242-53.
- Geurden, T., et al., Molecular epidemiology with subtype analysis of Cryptosporidium in calves in Belgium. Parasitology, 2007. 134(Pt.14): p. 1981-7.
- Duranti, A., et al., Risk factors associated with Cryptosporidium parvum infection in cattle. Zoonoses Public Health, 2009. 56(4): p. 176-82.
- Castro-Hermida, J.A., Y.A. Gonzalez-Losada, and E. Ares-Mazas, Prevalence of and risk factors involved in the spread of neonatal bovine cryptosporidiosis in Galicia (NW Spain) [Abstract]. Vet Parasitol, 2002. 106(1): p. 1-10.
- Harp, J.A., D.B. Woodmansee, and H.W. Moon, Resistance of calves to Cryptosporidium parvum: effects of age and previous exposure. Infect Immun, 1990. 58(7): p. 2237-40.
- Mosier, D.A., et al., Bovine humoral immune response to Cryptosporidium parvum. J Clin Microbiol, 1992. 30(12): p. 3277-9.
- Vieira, P.M., et al., Molecular characterisation of Cryptosporidium (Apicomplexa) in children and cattle in Romania. Folia Parasitol (Praha), 2015. 62.
- Hajdusek, O., O. Ditrich, and J. Slapeta, Molecular identification of Cryptosporidium spp. in animal and human hosts from the Czech Republic. Vet Parasitol, 2004. 122(3): p. 183-92.
- Wielinga, P.R., et al., Molecular epidemiology of Cryptosporidium in humans and cattle in The Netherlands. Int J Parasitol, 2008. 38(7): p. 809-17.
- Alves, M., et al., Subgenotype analysis of Cryptosporidium isolates from humans, cattle, and zoo ruminants in Portugal. J Clin Microbiol, 2003. 41(6): p. 2744-7.
- Trotz-Williams, L.A., et al., Calf-level risk factors for neonatal diarrhea and shedding of Cryptosporidium parvum in Ontario dairy calves. Prev Vet Med, 2007. 82(1-2): p. 12-28.
- Meganck, V., G. Hoflack, and G. Opsomer, Advances in prevention and therapy of neonatal dairy calf diarrhoea: a systematical review with emphasis on colostrum management and fluid therapy. Acta Vet Scand, 2014. 56: p. 75.
- Shobhamani, B., et al., Cryptosporidiosis in calves with other concurrent infections [Abstract]. Journal of Parasitic Diseases, 2005. 29(2): p. 161-163.
- Kalkanov, I., et al., Clinical and morphological investigations in a spontaneous cryptosporidium enteritis outbreak in calves. Bulgarian Journal of Veterinary Medicine, 2015.
- Holland, R.E., et al., Malabsorption of vitamin A in preruminating calves infected with Cryptosporidium parvum [Abstract]. Am J Vet Res, 1992. 53(10): p. 1947-52.
- Bhat, S.A., et al., Comparison of nested PCR and microscopy for the detection of cryptosporidiosis in bovine calves. J Parasit Dis, 2014. 38(1): p. 101-5.
- Operario, D.J., et al., Correlation between diarrhea severity and oocyst count via quantitative PCR or fluorescence microscopy in experimental cryptosporidiosis in calves. Am J Trop Med Hyg, 2015. 92(1): p. 45-9.
- Kuhnert-Paul, Y., et al., Cryptosporidiosis: comparison of three diagnostic methods and effects of storage temperature on detectability of cryptosporidia in cattle faeces. Parasitol Res, 2012. 111(1): p. 165-71.
- Brook, E.J., et al., Detection of Cryptosporidium oocysts in fresh and frozen cattle faeces: comparison of three methods. Lett Appl Microbiol, 2008. 46(1): p. 26-31.
- Chartier, C., et al., Detection of Cryptosporidium oocysts in fresh calf faeces: characteristics of two simple tests and evaluation of a semi-quantitative approach [Abstract]. Vet J, 2013. 198(1): p. 148-52.
- Jenkins, M., et al., Protection of calves against cryptosporiosis by oral inoculation with gamma-irradiated Cryptosporidium parvum oocysts. J Parasitol, 2004. 90(5): p. 1178-80.
- Harp, J.A. and J.P. Goff, Strategies for the control of Cryptosporidium parvum infection in calves. J Dairy Sci, 1998. 81(1): p. 289-94.
- Paraud, C., et al., Control of cryptosporidiosis in neonatal goat kids: efficacy of a product containing activated charcoal and wood vinegar liquid (Obionekk(R)) in field conditions [Abstract]. Vet Parasitol, 2011. 180(3-4): p. 354-7.
- Watarai, S., Tana, and M. Koiwa, Feeding activated charcoal from bark containing wood vinegar liquid (nekka-rich) is effective as treatment for cryptosporidiosis in calves. J Dairy Sci, 2008. 91(4): p. 1458-63.
- Nasir, A., et al., Treating Cryptosporidium parvum infection in calves [Abstract]. J Parasitol, 2013. 99(4): p. 715-7.
- Weyl-Feinstein, S., et al., Short communication: effect of pomegranate-residue supplement on Cryptosporidium parvum oocyst shedding in neonatal calves [Abstract]. J Dairy Sci, 2014. 97(9): p. 5800-5.
- EMA, SPC Halocur 0,5 mg/ml orale oplossing voor kalveren.
- Peeters, J.E., et al., Specific serum and local antibody responses against Cryptosporidium parvum during medication of calves with halofuginone lactate. Infect Immun, 1993. 61(10): p. 4440-5.
- Grinberg, A., et al., Controlling the onset of natural cryptosporidiosis in calves with paromomycin sulphate. Vet Rec, 2002. 151(20): p. 606-8.
- Naciri, M., et al., The effect of halofuginone lactate on experimental Cryptosporidium parvum infections in calves [Abstract]. Vet Parasitol, 1993. 45(3-4): p. 199-207.
- Jarvie, B.D., et al., Effect of halofuginone lactate on the occurrence of Cryptosporidium parvum and growth of neonatal dairy calves. J Dairy Sci, 2005. 88(5): p. 1801-6.
- Klein, P., Preventive and therapeutic efficacy of halofuginone-lactate against Cryptosporidium parvum in spontaneously infected calves: a centralised, randomised, double-blind, placebo-controlled study. Vet J, 2008. 177(3): p. 429-31.
- Villacorta, I., et al., Efficacy of halofuginone lactate against Cryptosporidium parvum in calves. Antimicrob Agents Chemother, 1991. 35(2): p. 283-7.
- Constable, P.D., Treatment of calf diarrhea: antimicrobial and ancillary treatments. Vet Clin North Am Food Anim Pract, 2009. 25(1): p. 101-20, vi.
- De Waele, V., et al., Control of cryptosporidiosis in neonatal calves: use of halofuginone lactate in two different calf rearing systems [Abstract]. Prev Vet Med, 2010. 96(3-4): p. 143-51.
- Shahiduzzaman, M. and A. Daugschies, Therapy and prevention of cryptosporidiosis in animals. Vet Parasitol, 2012. 188(3-4): p. 203-14.
- Todd, C.G., et al., Nonsteroidal anti-inflammatory drug therapy for neonatal calf diarrhea complex: Effects on calf performance. J Anim Sci, 2010. 88(6): p. 2019-28.
- Todd, C.G., et al. The efficacy of meloxicam (Metacam®) as an adjunct therapy in the treatment of neonatal calf diarrhea complex. in Conference on Calf Management. 2007. Steinkjer, Norway.