Brachyspira
Brachyspira komt steeds meer in de belangstelling, en terecht, gezien de problemen die hiermee optreden in het veld.
Enkele cijfers (1) met betrekking tot effecten:
- Sterfte ten gevolge van de introductie van een nieuwe infectie (in een groep van 3-12 weken oud):
- Acute fase: 1-4% uitval na spenen
- Chronische fase: 1-1,5 % uitval
- Effect op groei en voederconversie (vc):
- Acute fase: groeiverschil 35-150 gram, vc verschil 0,1-0,3
- Chronische fase: groeiverschil 30-35 gram, vc verschil 0,3 (4-8 extra dagen nodig)
Voor de aanpak op bedrijfsniveau zijn er verschillende mogelijkheden. Tijd om deze kiem hier eens goed onder de loep te nemen en de kennis te delen.
Het agens
Er zijn maar weinig kiemen die zo vaak van naam veranderd zijn als Brachyspira.
ln 1921 werd varkensdysenterie voor het eerst beschreven door Whiting, Doyle en Spray, in de USA. Het ziektebeeld werd later omgedoopt tot Vibrio (Dysenterie Doyle / ziekte van Doyle, in 1944 beschreven door de Amerikaanse onderzoeker L.P. Doyle). De veroorzaker werd geïsoleerd en geïdentificeerd door Harris et al. in 1972 en genaamd Treponema. Vervolgens werd de kiem in 1992 door Stanton hernoemd tot Serpulina, en sinds 1997 bekend onder de naam Brachyspira (Ochiai et al.) Het is een Gram-negatieve bacterie, groeit anaeroob, is beperkt zuurstof tolerant en bezit hemolytische eigenschappen. Het is een spiraal vormige (spirocheet) kiem met 2 sets van flagellae (8).
Voorkomen
De bacterie die van oudsher bij het varken bekend is en die als pathogeen beschouwd wordt is de sterk hemolytische Brachyspira hyodysenteriae.
Daarnaast wordt er o.a. de zwak hemolytische Brachyspira pilosicoli gevonden als veroorzaker van Porcine Intestinal Spirochaetosis (PIS) of Porcine Colonic Spirochaetosis (PCS). Dit is een aandoening met wat mildere verschijnselen.
Ook worden in varkens zwak hemolytische Brachyspira spp gevonden zoals Brachyspira innocens, Brachyspira intermedia en Brachyspira murdochii. Deze soorten worden voor varkens als niet- of minder pathogeen beschouwd.
De indeling was destijds vooral gebaseerd op sterk en zwak hemolytische eigenschappen. Inmiddels hebben moderne analysetechnieken hun intrede gedaan en zo is in 2009 voor het eerst het genoom (op basis van sequencing) van B. hyodysenteriae gepubliceerd (2). Sindsdien heeft dit Brachyspira onderzoek een behoorlijke vlucht genomen en is inmiddels al van meerdere Brachyspira spp het genoom vastgesteld.
Daarnaast kunnen isolaten op basis van lipopolysacchariden uit de celwand onderverdeeld worden in minstens 9 serogroepen die allemaal verschillende serotypes bevatten.
Symptomen
Brachyspira hyodysenteriae veroorzaakt een besmettelijke ontsteking van de dikke darm bij varkens van alle leeftijden en alle categorieën; van fokmateriaal tot biggen en zeugen. Het belangrijkste klinische symptoom is diarree met slijmerige, bloederige, cementkleurige faeces. Verder apathie, ingevallen flanken, vermagering en bleek terugvallende dieren met anemie.
Naast een acuut verloop is ook een chronisch beeld bekend. Wat dan vooral opvalt is een slechte voederconversie en verminderde groei.
lndien zeugen in de lactatie (chronische) problemen krijgen, dan kan dat ook een verminderde vruchtbaarheid tot gevolg hebben.
Pathogenese
De kiem maakt gebruik van zijn schroefvormige beweeglijkheid, dringt de crypten van het colon en caecum binnen en vermeerdert zich daar. Er is een actieve invasie van de slijmbekercellen en penetratie van de intercellulaire ruimtes en lamina propria. De bacterie gaat niet dieper dan de intestinale mucosalaag (Salmonella spp bijvoorbeeld gaat nog dieper) en persisteert in het dikke darmslijmvlies.
Een en ander leidt tot degeneratie en ontsteking van de oppervlakkige mucosa, hypersecretie door het mucosa-epitheel en multifocale puntbloedingen (ten gevolge van hemolysines/cytotoxines; tlyA, tlyB, tlyC) op het mucosale oppervlakte. Er worden diffuse laesies en oedeem gevonden in de dikke darm.
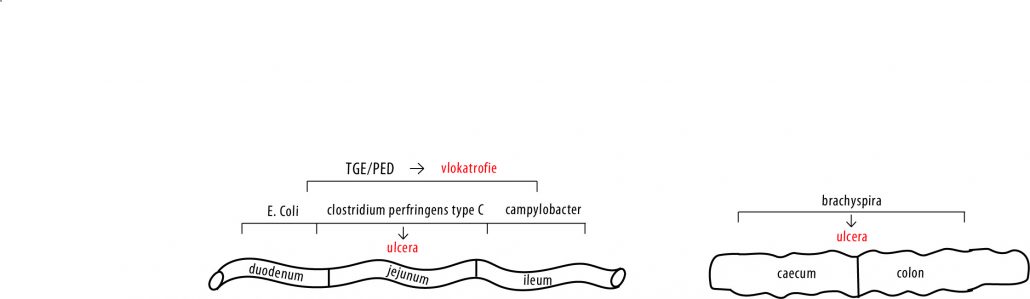
Voorkeurslocatie van kiemen in het maagdarmkanaal van het varken
Verminderde reabsorptiecapaciteit in de dikke darm van endogene secretieproducten, die nog altijd vanuit het niet-aangetaste dunne darm epitheel komen, resulteert eveneens in diarree.
Met de genoom sequencing, die er is van B. hyodysenteriae, is er ook een plasmid gevonden die de kolonisatie van het colon zou beïnvloeden. Bij gemis van het plasmid zou er minder kolonisatie optreden (2).
Er zijn verschillende potentiële virulentie factoren onderzocht die kolonisatie door B. hyodysenteriae bevorderen (2,3). Dat zijn hemolysinen, phospholipases, lipooligosaccharide en virulentie factoren die te maken hebben met chemotaxis, motiliteit, aanvullende factoren voor substraat gebruik, ijzer-binding, luchttolerantie en celoppervlak lipoproteïnen.
Diagnose
Brachyspira diagnose kan worden gesteld middels mestonderzoek. Swabs uit het rectum of mestmonsters, beiden zijn geschikt voor onderzoek. Bij voorkeur wordt materiaal afgenomen van dieren met diarree die (nog) niet behandeld zijn met antibiotica. De monsters moeten vers onderzocht worden; dus gekoeld en snel op transport en niet invriezen. Omdat brachyspiren anaeroob groeien, dienen potjes luchtdicht gesloten te zijn en swabs moeten met anaeroob medium verzonden worden.
Afhankelijk van het doel van het onderzoek kunnen specifiek testen worden gedaan. De IFT kan geen onderscheid maken tussen pathogene en niet-pathogene Brachyspira soorten.
Om de kiem in handen te krijgen en het onderscheid wel te maken wordt op het laboratorium een kweek gedaan, op selectief medium. Verder zijn er ook MALDI-TOF MS en PCR beschikbaar om de kiem te identificeren. Voor PCR is droog materiaal nodig (dus swabs zonder medium inzenden).
Sinds de typering van het genoom is veel bekend geworden over expressie van oppervlakte eiwitten. De volgende stap is het ontwikkelen van een ELISA om dierpopulaties te detecteren die geïnfecteerd zijn met B. hyodysenteriae. Dit zou dan prima ingezet kunnen worden voor screening van dierpopulaties in het kader van monitoring. Commercieel is er (nog) geen test beschikbaar.
Onderzoek van vleesdrip zou ook gebruikt kunnen worden om antilichamen aan te tonen (4).
Verder is het deels gelukt om de kiem (met PCR) aan te tonen in speeksel van varkens (5).
Differentiaal diagnose
- Salmonellose
- TGE
- PED
- Trichuris suis
- E. coli
Epidemiologie
Op varkensbedrijven zijn de zeugen drager. Via de faeces vindt uitscheiding van de kiem plaats.
Biggen worden via de orale route besmet. Problemen treden meestal op bij de vleesvarkens en bij biggen na het spenen. Daarnaast kunnen ook bij dieren in de opfokfase en bij zeugen symptomen voorkomen.
De incubatietijd is 5-7 dagen (soms zelfs tot 3 maanden). Er is een langzame verspreiding door het koppel met een morbiditeit tot 90%. De uitval blijft daarbij beperkt.
Uitscheiding via de faeces van het varken na klinisch herstel is zéér lang en tot wel 90 dagen. Van diverse andere diersoorten (6) is de uitscheidingsduur bekend: hond 13 dagen, rat 2 dagen, mus 8 uren en vlieg 4 uren. Muizen daarentegen kunnen de kiem tot 180 dagen lang uitscheiden en spelen een belangrijke rol als reservoir voor verdere verspreiding.
ln de omgeving (mest) kunnen de kiemen prima overleven (6), afhankelijk van de temperatuur: in mest 3-7 dagen bij temperatuur van 25⁰C, en onder de 10⁰C al 24-38 dagen.
Overdracht is ook mogelijk via de mens (kleding, laarzen) en vrachtauto’s. In grond kan de kiem overleven 18 dagen bij 4⁰C. Ook in vervuild water is bij 5⁰C de kiem 61 dagen lang te vinden.
Door stress kan uitscheiding van de kiem geactiveerd worden (8). Overbevolking, temperatuurschommelingen, verplaatsen, mengen van dieren, verandering in voer en vooral introductie van gelten in de zeugenstapel zijn zulke stress-momenten.
Verschillen in symptomen tussen bedrijven kunnen deels samenhangen met de samenstelling van het normale intestinale microbioom in de varkens op die bedrijven. En dat microbioom op zijn beurt kan weer beïnvloed worden door de samenstelling van het voer. Dus een indirect effect op de kolonisatie van Brachyspira spp. Dit is beschreven (7) voor B. hyodysenteriae en B. pilosicoli .
lmmuniteit (8)
Er is sprake van opbouw van immuniteit na infectie. Dieren die (met antibiotica) behandeld zijn bouwen géén weerstand op. Daardoor kunnen deze dieren ook weer opnieuw besmet worden! lmmuniteit na infectie kan serotype specifiek zijn. Na herstel van een B. hyodysenteriae infectie kan er gedurende 17 weken immuniteit verkregen worden. Sommige dieren echter blijven gevoelig; ongeveer 10% is pas beschermd na twee challenges.
Vooral lgA is van belang. lgA niveaus in het colon duiden op een recent contact. Serumantistoffen zijn vanaf 10 dagen aanwezig en blijven 4-5 maanden aantoonbaar. Serum lgG niveaus correleren met de duur van klinische symptomen. Geen van beiden is sterk gecorreleerd aan bescherming.
In herstellende biggen is gevonden: inhibitie van leukocytenmigratie in het perifere bloed, vertraagde overgevoeligheidsreactie en T-cel respons t.o.v. B. hyodysenteriae. Hieruit wordt geconcludeerd dat cellulaire immuniteit ook een rol zal spelen.
Er is géén kruisbescherming tussen serotypes na vaccinatie met een bacterin (vaccin op basis van afgedode bacterie). Er is zeer waarschijnlijk sprake van maternale immuniteit, dus zeugen geven dit door aan hun biggen. Bacterin vaccins zouden een graad van bescherming geven.
Therapie
Zodra er klinische problemen zijn op een bedrijf en een brachyspira infectie is aangetoond, wordt vaak behandeld met antibiotica. Therapie met de volgende werkzame stoffen worden conform het formularium varken (9) geadviseerd:
- Oraal: 1e keus: 1 Tiamulin / 1 Tylvalosine / Valnemuline / *Lincomycine / *Tylosine
- Oraal: 2e keus: Lincomycine / Spectinomycine
- Parenteraal: 1e keus: Tiamulin
* : geen voorkeur voor een bepaald antibacterieel middel, in alfabetische volgorde weergegeven.
Inzet van antibiotica verdient aandacht en kan nogal eens aanleiding zijn tot teleurstellende resultaten. Daarbij is het goed de volgende zaken kritisch te bekijken:
- dosering van de medicatie;
- lengte behandelingsduur;
- mogelijkheid tot herbesmetting vanuit de omgeving;
- juiste diagnose;
- insleep door latent geïnfecteerde varkens (dragers);
- knaagdieren, mest en andere vectoren (o.a. vliegen);
- secundaire infecties.
Resistentie (10,11,12,13,14)
Informatie vanuit de Gezondheidsdienst voor Dieren en de Universiteit Gent geven enig inzicht in de gevoeligheid van de beschikbare antibiotica. Daarnaast geeft de literatuur informatie mbt MIC waarden voor de diverse antibiotica:
- Tiamuline: NL/België: resistentie komt voor (10,11). Voor Brachyspira hyodysenteriae zijn in de literatuur (12,13,14) MIC90 waarden gevonden van:
- 2 µg/ml in de USA (2016; n=40)
- 8 µg/ml in Spanje (2011; n=87)
- 4 µg/ml in België (2017; n=30)
- Tylvalosine: resistentie komt voor (sinds 2013 wordt een daling in resistentie waargenomen in België ten opzichte van Tylvalosine) (10,11). In de literatuur (13,14) is het volgende te vinden voor MIC90 waarden t.o.v. B. hyodysenteriae:
- 16 µg/ml in Spanje
- 16 µg/ml in België
- Valnemuline: resistentie komt voor (10,11). De literatuur (12,13,14) geeft de volgende MIC90 waarden aan mbt. B. hyodysenteriae:
- 1 µg/ml in USA
- 4 µg/ml in Spanje
- 2 µg/ml in België
- Lincomycine / Tylosine in NL: 2002: 100% resistent en in 2004: 70% resistent (n=16) (10,11). In literatuur (12,13,140 het volgende mbt MIC90 waarden te vinden:
- Lincomycine
- 32 µg/ml in USA
- > 64 µg/ml in Spanje
- 32 µg/ml in België
- Tylosine
- > 128 µg/ml in USA
- > 128 µg.ml in Spanje
- > 128 µg/ml in België
- Lincomycine
Naast inzet van antibiotica dienen hygiënische maatregelen zoals schoonmaken, ontsmetten en laten drogen, onderdeel te zijn van de totale aanpak van brachyspira op het varkensbedrijf.
Bestrijding: algemene maatregelen
Over eradicatie zijn de meningen verdeeld: is het mogelijk en op welke manier dat dan wel zou dienen te gebeuren.
De meest invasieve methode is depop-repop. Dat wil zeggen volledig schoon maken, vrij van mestresten, opdrogen, en een nieuwe populatie inleggen op het bedrijf. Dit vergt een behoorlijke investering en de vraag is dan vervolgens: hoe vrij te blijven van de kiem?
De andere manier is vanuit een bestaande populatie Brachyspira-vrij worden. Maar hoe zou dat moeten? ln de USA zijn er wel diverse eradicatie protocollen beschreven met behulp van inzet van antibiotica. Uitgevoerde procedures geven daar een 80% slagingskans (8).
De specialisten op dit gebied zijn het erover eens dat het zeer lastig is. Methoden zijn nog immer in ontwikkeling.
Specifieke preventie: vaccinatie
Er is op dit moment géén commercieel Brachyspira-vaccin beschikbaar in Europa. Daarom worden onder de cascaderegeling bedrijfsspecifieke vaccins tegen Brachyspira ingezet. Er zijn wetenschappelijke artikelen die beamen dat daardoor de uitscheiding van Brachyspira minder wordt (15,16,17).
Daarnaast ziet men in het veld vaak een vermindering van de klinische symptomen. Dit varieert van geen acute uitbraken meer, verschijnselen bijna geheel weg, het gaat redelijk goed, tot een verschuiving van de problemen naar oudere leeftijd in de vleesvarkensstal.
Verder blijkt in de praktijk dat inzet van bedrijfsspecifieke vaccins tegen Brachyspira zelfs op bedrijven met een biologisch houderij systeem zinvol is. Voorwaarde is wel dat overige diarree-veroorzakende factoren goed aangepakt worden voordat er gestart wordt met een Brachyspira-vaccinatie.
Ripac-Labor
Dopharma zet zich samen met u in voor een gezonde landbouwhuisdierensector. Bedrijfsspecifieke vaccins kunnen onder wettelijk duidelijk omschreven voorwaarden in bijzondere gevallen worden ingezet. De toepassing van een bedrijfsspecifiek vaccin kan in deze gevallen een passend antwoord zijn op specifieke bedrijfsproblematiek. Voor inzet van de bedrijfsspecifieke vaccins dient de Cascade regeling gevolgd te worden (18). Dit is omschreven in het Besluit Diergeneeskundigen.
Dopharma kan u helpen met raad en daad: een sterk team voor technische ondersteuning en de lange ervaring van Ripac-Labor in de diagnostiek, isolatie, typering en uiteindelijk productie van bedrijfsspecifieke vaccins, zorgen voor een solide basis.
Referentie
- Muirhead et al. Managing Pig Health and the Treatment of Disease (1997).
- Bellgard et al. (2009) Genome sequence of the pathogenic intestinal spirochete Brachyspira hyodysenteriae reveals adaptations to its lifestyle in the porcine large intestine. PLoS One 4(3): e4641.
- Black et al. (2015) Analysis of multiple Brachyspira hyodysenteriae genomes confirms that the species is relatively conserved but has potentially important strain variation. PLoS One 10(6):e0131050.
- Song et al. The use of ELISA’s for monitoring exposure of pig herds to Brachyspira hyodysenteriae. BMC Vet Res 2012 Jan 17;8:6.
- Boyer P. et al. Testing oral fluid samples to diagnose swine dysentery in commercial farms. IPVS Mexico. 2014 June 8-11.
- The Merck Veterinary Manual (2010), 10th edition.
- Hampson DJ. Brachyspiral colitis: an evolving problem. IPVS Mexico. 2014 June 8-11.
- Diseases of Swine (2OI2), 10th edition.
- WVAB Formularium varken (2012).
- Gezondheidsdienst voor Dieren. Monitoring Diergezondheid Jaarverslag 2011.
- Persoonlijke communicatie Universiteit Gent (2017).
- Nandita S. et al. Antimicrobial susceptibility patterns of Brachyspira species isolated from swine herds in the United States. JCM 2016 August;54(8):2109-2119.
- Hidalgo A. et al. Trends towards lower antimicrobial susceptibility and characterization of acquired resistance among clinical isolates of Brachyspira hyodysenteriae in Spain. Antimicrob. Agents Chemother. 2011 July;55(7):3330-3337.
- Mahu M. et al. Presence and mechanisms of acquired antimicrobial resistance in Belgian Brachyspira hyodysenteriae isolates belonging to different clonal complexes. Vet. Microbiol. 2017;207:125132.
- Hidalgo A, et al. Control of swine dysentery with an inactivated autovaccine against brachyspira hyodysenteriae in a multiplier herd. IPVS Durban. 2008 June 22-26.
- Rubio P. Spanish experiences with swine dysentery. ESPHM Brugge. 2012 April 25-27.
- Deza J, et al. Control of swine dysentery with an inactivated autovaccine against B. hyodysenteriae in a finish pig farm of Spain. IPVS Mexico. 2014 June 8-11.
- Besluit diergeneeskundigen. Hoofdstuk 5. Diergeneesmiddelen. 2018.