Distocur; u wilt toch ook uw melkvee tegen leverbot behandelen tijdens lactatie en droogstand?
Bedrijven die aan weidegang doen of vers gras voeren, kunnen vroeg of laat te maken krijgen met leverbot. Leverbot wint steeds meer terrein in West-Europa. Ook in Nederland en België worden steeds meer besmettingen gemeld. Sterfte door leverbot komt in runderen bijna niet voor. Maar is deze ziekte daarom minder belangrijk?
Leverbot
Leverbotinfectie of distomatose is een parasitaire ziekte bij herkauwers die veroorzaakt wordt door trematoden of platwormen. De grote leverbot die voorkomt in onze contreien draagt de naam Fasciola hepatica. Deze ziekte veroorzaakt wereldwijd belangrijke economische verliezen. De verliezen bestaan voor het grootste deel uit melkproductiedaling, gewichtsverlies en afgekeurde levers in het slachthuis. Daarnaast kan een infectie met leverbot het effect van andere ziekteverwekkers versterken of verminderen of interfereren met hun diagnose (zie verder in deze tekst). Wat wel eens vergeten wordt, is dat deze parasiet ook problemen kan geven bij andere graseters en ook bij de mens.
Leverbot – prevalentie en risicofactoren
Waar vroeger leverbotinfecties alleen maar voorkwamen in meer zuidelijke gelegen landen zien we de laatste jaren dat leverbotinfestaties ook bij ons meer en meer voorkomen. Veranderde klimatologische omstandigheden (mildere winters, hoge temperaturen en meer neerslag) zorgen ervoor dat de omstandigheden voor de ontwikkeling van de leverbot verbeteren. Daarnaast zorgen de veranderende weersomstandigheden er ook voor dat de periode met gevaar voor besmetting met leverbot steeds vroeger in het weideseizoen begint. Maar er zijn nog andere risicofactoren die de uitbreiding van leverbot op een bedrijf in de hand werken. Uit een studie uitgevoerd in Denemarken bleek dat vaarzen en droge koeien die grazen op natte weiden significante risicofactoren zijn om de infectie met leverbot op het bedrijf in stand te houden. Ook de aankoop van besmette koeien, geen of slechte behandeling van besmet jongvee en te weinig controle op al dan niet voorkomen van resistentie mogen niet vergeten genoemd te worden. Zo kan resistentie tegen triclabendazol ervoor zorgen dat leverbotinfecties gestaag uitbreiden.
Leverbot – levenscyclus
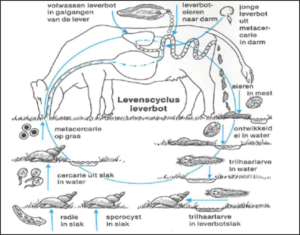
De leverbot heeft een indirecte cyclus, waarin de poelslak Galba truncatula als tussengastheer een belangrijke rol speelt. De aanwezigheid van deze poelslak is noodzakelijk om de cyclus van de leverbot te vervolledigen.
In de lever legt de volwassen leverbot eitjes die, samen met de gal, in de mest van het rund worden uitgescheiden. Een volwassen leverbot kan per dag wel 4.000 tot 7.000 eieren produceren. In de buitenwereld komen uit de eitjes trilhaarlarven of miracidiumlarven. Deze miracidiumlarven hebben binnen de 24 uur een poelslak nodig om te kunnen overleven. In de slak ontwikkelen de larven verder tot staartlarven. Deze larven verlaten de slak en komen zo in de weide terecht. Na het verliezen van zijn staart kapselt de larve zich in tot een besmettelijke cyste (metacercaria). Bij het opeten van de cysten via het gras raken graseters besmet. Binnen enkele uren na opname ontstaan juveniele leverbotjes in de dunne darm. Deze botjes boren zich door de darmwand en migreren door de buikholte richting lever en galgangen.
In het rund loopt de levensduur van een leverbot uiteen van 6 maanden tot twee jaar.
Figuur 1 De leverbotcyclus in het rund met tussengastheer Galba truncatula (bron: DGZ – Ugent)
Leverbot – symptomen
Door de migratie van de parasiet in de lever en de beschadigingen die daar worden aangebracht kan er een hele waaier aan symptomen ontstaan. Deze kunnen gaan van verminderde melkproductie, gewichtsverlies, verminderde fertiliteit, diarree tot sterfte.
Bij rundvee is een infectie meestal subklinisch en dus sluimerend, met economische consequenties tot gevolg. Bij schapen kan het vooral bij jonge dieren aanleiding geven tot acute sterfte.
Leverbot – diagnose
De diagnose van leverbot kan op verschillende manieren worden gesteld. Niet elke methode is op elk moment van de infectie relevant.
Mestonderzoek
Met mestonderzoek (sedimentatie-flotatie) kan het aantal eieren uitgescheiden door volwassen wormen worden aangetoond. De mest (rectaal genomen) wordt microscopisch onderzocht op de aanwezigheid van leverboteieren. De aanwezigheid van eieren van de parasiet is niet alleszeggend en kan ook niet op elk tijdstip worden uitgevoerd. Zo is er in de prepatente periode geen uitscheiding van eieren door de immature stadia. Daarbij staat het aantal eieren gevonden in de faeces niet altijd in relatie met het aantal adulte parasieten in de lever. Na het opnemen van een metacercaria duurt het gemiddeld 10 tot 12 weken tot de leverbot volwassen is en eieren kan uitscheiden. De beste periode om mestonderzoek te doen is 3 maanden na het einde van het weideseizoen. Omwille van intermitterende uitscheiding is het uiteraard het best om meerdere dieren uit een groep te bemonsteren. Het aantonen van leverboteieren in de mest geeft informatie over de infestatie in de groep.
Aantonen van antistoffen in het bloed
Een leverbot infestatie geeft aanleiding tot het vormen van antistoffen in het bloed. Vier weken na het opdoen van een leverbotinfectie kunnen deze antistoffen in het bloed aangetroffen worden met behulp van een ELISA-test. De antistoffen zijn aantoonbaar tot 180 dagen na een infectie. Dit impliceert dat een besmetting opgelopen in het najaar, in het daaropvolgende jaar nog kan zorgen voor een positieve test op afweerstoffen in het bloed. Deze test kan dus niet gebruikt worden om een effectieve besmetting aan te tonen. Naast het opsporen van antistoffen kan er in het bloed ook gekeken worden naar de leverenzymgehaltes gamma-glutamyltransferase (GGT) en glutamaatdehydrogenase om een idee te krijgen van de leverbeschadiging die er heeft plaats gevonden.
Aantonen van antistoffen in de melk
Via tankmelkonderzoek wordt de Optische Densiteit Ratio (ODR) van antistoffen gericht tegen Fasciola hepatica bepaald. Dit tankmelkonderzoek kan het hele jaar gebeuren, maar preferentieel voor het einde van het weideseizoen. Hiermee krijgt de veehouder een idee over de graad van besmetting op bedrijfsniveau. Een ODR < 0,30 wordt als negatief beschouwd. Een ODR tussen 0,30 en 0,50 wijst op een leverbotbesmetting zonder ernstige productieverliezen. Een ODR > 0,50 wijst op een ernstige besmetting met leverbot met mogelijk negatieve gevolgen op melkgifte en fertiliteit.
Aantonen van antigenen in de mest
Met een ELISA-test die antigenen in de mest opspoort (hoge gevoeligheid) kan er gekeken worden of een dier al dan niet zwaar besmet is.
Lijkschouwing
Op gestorven dieren kan ook gekeken worden hoe ernstig de lever is beschadigd.
Leverbot – immuniteitsontwikkeling
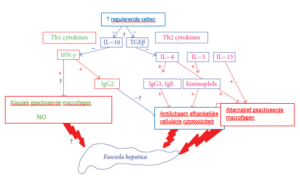
De immuunrespons als reactie op de aanwezigheid van pathogenen valt onder te verdelen in aspecifieke immuunrespons en een verworven immuunrespons. De aspecifieke immuunrespons is zoals het woord al aangeeft niet specifiek voor een bepaald pathogeen en zal bijgevolg niet leiden tot een immunologisch geheugen. Bij de verworven of adaptieve immuunrespons zijn de B-cellen die zich kunnen differentiëren tot antistof secreterende plasmacellen en de T-cellen die zich differentiëren tot CD8+ cytotoxische T-cellen, CD4+ helper T-cellen en regulatoire T-cellen van belang. Er is veel bekend over de T-helpercel type 1 (Th1-cel) en type 2 (Th2-cel). De Th1-cel produceert voornamelijk IFN-γ en is van belang voor de activatie van macrofagen, voor de verwijdering van intracellulaire pathogenen en cellulaire immuniteit. De Th2-cel produceert voornamelijk IL-4 en is van belang voor de activatie en recruitment van ontstekingscellen en voor humorale immuniteit.
Infecties met Fasciola hepatica gaan gepaard met release van hoge concentraties Interleukine 4 (IL-4), IL-5 en IL-13 wat uiteindelijk resulteert in verhoogde IgE niveaus, eosinofilie en andere immuun responsen geassocieerd met het Th2 subtype. De vroege differentiatie tussen Th1/Th2 cellijn van de helper T-cellen wordt in de hand gewerkt door cytokines als IL-4 en IFN-γ. De hoge concentratie IL-4 bij een leverbotinfectie en bijgevolg de sterke Th2 immuunrespons zorgt tevens voor een neerwaartse initiële Th1 immuunrespons met minder productie van IFN-γ en verlaagde reactiviteit van lymfocyten tot gevolg.
Hieronder ziet u een schematische voorstelling van de immuunrespons regulatie geïnduceerd tegen Fasciola hepatica. (Bron: E. Moreau, Alain Chauvin)
Leverbot – immunomodulerende eigenschappen
Wormen hebben verschillende manieren ontwikkeld om aan de immuunrespons van de gastheer te ontsnappen. Maizels et al. noemden ze daarom ook “De meesters van de immunomodulatie”.
Deze immunomodulerende eigenschappen zorgen ervoor dat de worm in de gastheer blijft bestaan en kunnen leiden tot interacties met inflammatoire en immuunmechanismen die betrokken zijn bij andere infecties, vaccinaties, allergische reacties of auto-immuunziekten.
Enkele voorbeelden:
Bovine tuberculose
Bovine tuberculose (BTB) veroorzaakt door Mycobacterium bovis is wereldwijd nog steeds een belangrijke ziekte bij koeien. De eradicatieprogramma’s in de meeste landen zijn gebaseerd op:
• SICCT (single intradermal comparative cervical tuberculin test)
• IFN-γ bloedtest (tweedelijnstest).
Zoals hierboven aangegeven wordt tijdens een leverbotinfectie de Th1 immuunrespons en daarmee de cellulaire immuniteit onderdrukt. Hierdoor kan mogelijk afbreuk gedaan worden aan de gevoeligheid van de twee screeningstesten gebruikt in het veld met vals negatieve resultaten tot gevolg.
Dit mogelijk verband werd aangetoond door Robin J. Flynn aan de universiteit in Dublin.
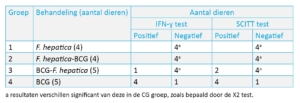
Om een mogelijke interferentie te onderzoeken vaccineerde hij dieren al dan niet geïnfecteerd met leverbot met BCG vaccin (avirulente stam die gebruikt wordt in de humane geneeskunde).
De SCITT en IFN-γ test uitgevoerd bij de verschillende groepen dieren gaf de volgende resultaten:
Uit bovenstaand experiment blijkt dat bij runderen geïnfecteerd met leverbot er mogelijk interferentie kan optreden met de bestaande screeningstesten voor BTB gebruikt in het veld.
Overmatige IL-4 secretie door leverbotinfectie is voornamelijk verantwoordelijk voor suppressie van Th1 cellulaire immuniteit die ontstaat na vaccinatie met Mycobacterium bovis.
De leverbot met zijn immuunmodulerende eigenschappen kan de vatbaarheid van de gastheer voor infecties met andere pathogenen verhogen. Immers het downregulerend effect van IL-4 op Th1 immuunrespons (welke gerelateerd is aan cellulaire immuniteit) kan ervoor zorgen dat bepaalde infecties waar deze immuniteit belangrijk is heftiger verlopen.
Salmonella dublin
Studies uitgevoerd in de late jaren 1970 en vroege jaren 1980 vonden dat co-infectie van runderen met Salmonella dublin en Fasciola hepatica leidde tot een verhoogde ernst van de klinische ziekte, een langer ziekteverloop en een verhoogde kans dat co-geïnfecteerde dieren dragers worden van S. dublin. De door F. hepatica onderdrukte pro-inflammatoire response bij Salmonella infectie zorgt ervoor dat de gevoeligheid voor deze intracellulaire parasiet toeneemt.
Escherichia coli O157
Escherichia coli O157 is een bacterie die verantwoordelijk is voor hemorragische diarree bij mensen. Runderen zijn reservoir van deze verocytotoxigene E. coli en zijn dus een mogelijk gevaar voor overdracht naar de mens. Uit een onderzoek uitgevoerd op de Universiteit in Liverpool is gebleken dat runderen die geïnfecteerd zijn met Fasciola hepatica een verhoogde kans op uitscheiding met de E. coli O157 vertonen. Door een goede controle van distomatose kan zo een mogelijke besmetting met E. coli O157 voorkomen worden.
Leverbot – preventie en behandeling
Bestrijding van de leverbot berust op twee pijlers.
Preventie
Een goed weidebeheerplan en het overdacht buiten zetten van dieren kan al een heel stuk helpen bij de bestrijding van leverbot. Met een aangepast weidebeheer is het contact tussen de eindgastheer en de infectieuze leverbotstadia sterk te verminderen.
Behandeling
Er zijn verschillende flukiciden op de markt in Nederland. Niet elke product is werkzaam tegen ieder stadium van de leverbot. Triclabendazol met een werkzaamheid tegen alle fasen van de leverbot was het middel dat gedurende jaren gebruikt is geweest om een infectie te bestrijden. Probleem is dat de leverbot steeds vaker resistent blijkt voor dit middel. Daarnaast kan triclabendazol niet gebruikt worden bij melkgevend vee. Producten met oxyclozanide kunnen gebruikt worden bij melkvee tijdens de lactatie en de volledige droogstandperiode en zijn actief tegen adulte leverbotten.
Dopharma heeft sinds kort Distocur 34 mg/ml met de actieve stof oxyclozanide in het productgamma. Dus behandeling van een leverbotinfectie of distomatose bij melkvee kan voortaan ook in Nederland zonder toepassing van de cascade.
Referenties
- M.A.A. Rana et al, Fascioliasis in cattle – A review. The Journal of Animal & Plant Sciences, 24(3):2014, pages: 668-675
- N.J. Beesley et al, Fasciola and Fasciolosis in ruminants in Europe: Identifying research needs. Transboundary and Emerging Diseases, 65 (Suppl. 1):2018, pages: 199-216
- D.J.L. Williams, Liver fluke – an overview for practitioners. http://www.cattleparasites.org.uk/
- N. Takeuchi-Storm et al, Patterns of Fasciola hepatica infection in Danish dairy cattle: implications for on-farm control of the parasite based on different diagnostic methods. Parasites & Vectors, 2018, 11:674
- Focus op Leverbot, Praktische handleiding. DGZ – Ugent
- E. Moreau and Alain Chauvin, Immunity against Helminths: Interactions with the Host and het incurrent infections. Journal of Biomedicine and Biotechnology, Volume 2010, Article ID 428593, 9 pages
- R.J. Flynn et al, Experimental Fasciola hepatica infection alters responses to tests used for diagnosis of bovine tuberculosis. Infection and immunity, Mar. 2007, Pages: 1373-1381
- M.M. Aitken et al, Effects of experimental Salmonella dublin infection in cattle given Fasciola hepatica thirteen weeks previously. Journal of Comparative Pathology Volume 88, Issue1, January 1978, pages: 75-84
- A.K. Howell et al, Co-infection with Fasciola hepatica may increase the risk of Escherichia coli O157 shedding in British cattle destined for the food chain. Prevetmed, 2017